短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中Q所处的周期序数是其主族序数的一半,请回答下列问题:
⑴T的最高价氧化物对应的水化物为_____________。
⑵原子的得电子能力:Q______W(填“强于”或“弱于”)。
⑶原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________。
⑷W的单质与其最高价氧化物对应的水化物的浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______________。
X、Y、Z均为短周期元素,它们在周期表中的相对位置如右图所示。已知X、Y、Z三元素的质子数之和为40,请回答:
| X |
|
|
| |
Y |
Z |
(1)写出X、Y、Z三元素的元素符号
X Y Z
(2)Y在周期表中位置
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则B为(填元素符号)____________,
画出A的离子结构示意图: ______________,
C的最高价氧化物的分子式:__________________
用电子式表示A的氢化物分子的形成过程:
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
最外层电子数是内层电子数的3倍 |
| C |
1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2) D在周期表中的位置为 ________________;
(3)B和C简单离子的半径大小为________>_______;(用离子符号表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_______(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)C和E形成的化合物是 ,所含的化学键的类型为 。
(10分)下表列出了①~⑥六种元素在元素周期表中的位置。
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是___ _(填写元素符号);
(2)元素①③⑥的氢化物的化学式分别是__ __;__ _ _;__ _ _.
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是______ ____________。
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。F原子核外最外层电子数与Na相同,其余各层电子均充满。
(1)E3+的价电子排布式为 。
(2)AB32— 的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22— 与B22+ 互为等电子体,B22+的电子式可表示为 ___________,1mol B22+ 中含有的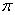 键数目为 。
键数目为 。
(4化合物DC2的晶胞结构如右图所示,形成的离子化合物的电子式为__________该离子化合物晶体的密度为a g/cm3,则晶胞的体积是 ____ cm3(只要求列算式,阿伏加德罗常数的值为NA)。
(10分)
⑴微粒AXn-核外有18个电子,则它的核电荷数为 ,核内中子数为 。
⑵由1H216O与2H217O所代表的物质中,共有 种元素, 种原子,
16O、17O的关系为 。(填同位素或同种原子或同种核素)
在原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)气态氢化物水溶液呈碱性的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的元素是_____________。
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。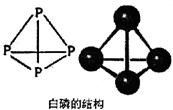
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
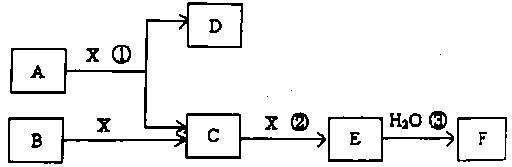
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填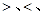 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
(2)XZ 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如图所示,则该化合物的化学式为 。