分子筛具有吸附能力强,热稳定性高等优良性能,使得分子筛获得广泛应用,某种型号分子筛的工业生产流程可表示如下: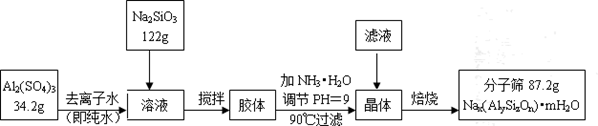
在滴加氨水调节pH=9的过程中,若pH控制不当,会有Al(OH)3生成,假设生产过程中铝元素、硅元素均没有损失,钠原子利用率为10%。
(1)分子筛的直径为4A(1A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得6A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用_______型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为________________________
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要还有 等离子。检验其中金属阳离子的操作方法是 ;
(4)加NH3•H2O调节pH后,加热到90℃并趁热过滤的原因可能是 。
(5)该生产流程中所得分子筛的化学式为 。(用氧化物形式表示)
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下: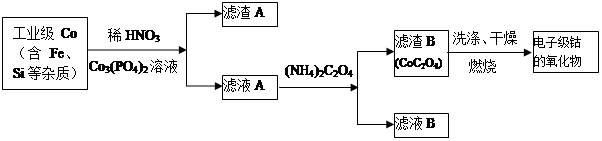
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式: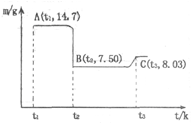
①AB段: ;
②BC段 。
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
(1)写出实验室利用KMnO4分解制取O2的化学方程式
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
(3)在滴定实验中,常用 (填“酸式”或“碱式”)滴定管量取KMnO4溶液。
(4)写出反应①的化学方程式
(5)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(6)上述流程中可以循环使用的物质有 、 (写化学式),鉴于此现用100吨软锰矿(含MnO287.0%),理论上可生产KMnO4晶体 吨(不考虑制备过程中原料的损失)。
硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下:
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式 、 。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是 。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是 (填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是 。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
【化学—选修2 化学与技术】
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如图:

回答下列问题:
(1)实验室模拟萃取槽需要用到玻璃仪器为: ,操作b的名称是______________。
(2)装置a中生成两种酸式盐,它们的化学式分别是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是____________________(结晶水部分不写)。
(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀硫酸 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |
[化学——选修2:化学与技术](15)
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:
⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。
⑵AlO(OH)与NaOH反应的化学方程式为 。
⑶在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
⑸该生产流程能实现 (填化学式)的循环利用。
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):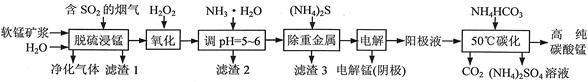
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,MnO4 - 可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
2.7 |
| 完全沉淀时 |
5.2 |
9.7 |
3.2 |
(1)H2S04溶解A1203的离子方程式是
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:( Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的: ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式: ;
③Ⅲ中加入MnS04的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 。(填化学式)
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
已知:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式
。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4 b.K2Cr2O7 c.H2O2 d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是
(填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”)。
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42—等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下: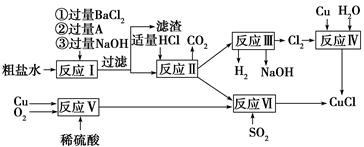
(1)A的化学式为________。
(2)写出反应Ⅴ的化学方程式______________________________________
(3)写出反应Ⅵ的离子方程式______________________________________
(4)本工艺中可以循环利用的物质是(用化学式表示)___________________________
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃ 燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_________________________
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。
碘化钠是制备无机和有机碘化物的原料,在医药上用作祛痰剂和利尿剂等。工业上用铁屑还原法制备NaI,其主要流程如下图: 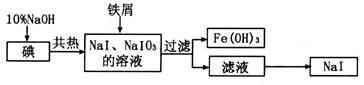
(1)写出铁屑转化为Fe(OH)3反应的离子方程式: 。
(2)判断碘已完全反应的方法是 。
(3)由滤液得到NaI晶体的操作是 。
(4)测定产品中NaI含量的方法是:
a.称取3.000g样品溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.100mol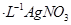 溶液滴定至终点,消耗
溶液滴定至终点,消耗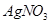 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有 ,
其中使用前需进行润洗的仪器是 ;
②上述样品中NaI的质量分数为 。