碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O="=" 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
(12分)以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图: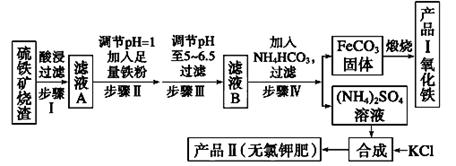

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是_______________________ _______。
(2)滤液B中加入NH4HCO3溶液的离子方程式 。
(3)煅烧FeCO3生成产品I的化学反应方程式为___________ __________________。
(4)已知几种盐的溶解度随温度变化的曲线如如图所示,产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 、趁热过滤、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是_______________,进一步提纯产品Ⅱ的方法是________________;
(6)步骤Ⅲ中可选用______________(填序号)试剂调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO•PbSO4•H2O),进行资源回收研究,设计实验流程如下: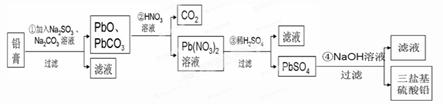
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):
(3)将步骤①和④的滤液合并,加入 PH=7,再经过 、冷却结晶、
、洗涤、干燥,可获得Na2SO4•10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为 (假设流程中原料无损失)。
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 |
外观 |
热分解温度 |
熔点 |
溶解性 |
| CO(NH2)2•H2O2 |
白色晶体 |
45℃ |
75~85℃ |
易溶于水、有机溶剂 |
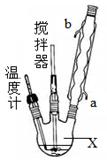
合成过氧化尿素的流程及反应装置图如下:
请回答下列问题:
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| NaClO浓度/mol·L-1 |
4.6 |
5.2 |
5.4 |
5.5 |
4.5 |
3.5 |
2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:________________________________________________________
_______________________________________________________________________________________。
(15分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式);
(2)酸浸时发生反应的离子方程式是 ;
(3)析出CuCl晶体时的最佳pH在 左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程: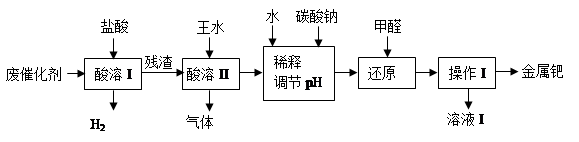
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3  3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。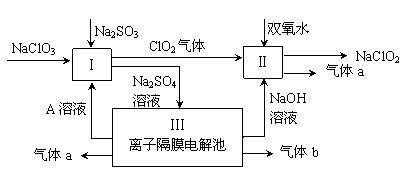
(1)双氧水的结构式为: ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填相同、不相同或无法判断)
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH===2NaNO2+H2O。工艺流程如下
(1)分解塔中填有大量的瓷环,其目的是:_____________________________。
(2)按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: ____________________________。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是_____________________________________,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为_____________________________________________。
(3)通入一定量的N2的目的是: ___________________________________。
(4)吸收塔中尾气如何再利用:_______________________________________。
锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如图所示。
请回答下列问题:
(1)操作①加快反应速率的措施有 (任写一种方法即可)
(2)加入少量30% H2O2溶液的目的是
(3)步骤③中调节溶液PH至8—10,宜选用的试剂为____________(填序号)。
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是_______、 (填化学式)。
(4)步骤⑤中,洗涤氯化锶晶体选用少量冰水的原因是
工业上用热风吹干六水氯化锶,选择的适宜温度范围是________________。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依据右表数据可以推算滤液中Sr2+物质的量浓度为___________________。
[化学--修2:化学与技术](15分)
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
(1) ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为 。缺点主要是产率低、产品难以分离,还可能污染环境。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 。此法提高了生产及储存、运输的安全性,原因是 。
(I)过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
试回答下列问题:
(1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1,并控制合成温度在25~30℃,其主要原因是 。
(2)从母液中分离出H2O2和尿素,采用的操作是 。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(II)某硝酸厂附近的空气主要污染物为氮的氧化物,为了保护环境和综合利用,可采用氨-碱两级吸收法,此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
(1)排空物质的主要成分为____________________________。
(2)进入吸收塔以前加一个缓冲器的目的是________________________________。
(3)从吸收塔排出的混合液用途之一为________________ 。
(4)空气的主要污染物为硫的氧化物和氮的氧化物.研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
则①和②分别为(写化学式)________________。