如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:
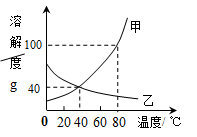
(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。
如图是A、B、C三种固体物质的溶解度曲线图,请回答:

(1)A、B、C三种物质的溶解度受温度影响最大的是 。
(2)P点表示的意义是 。
(3)t2℃时,三种物质的溶解度从大到小的顺序是 。
(4)在t1℃时,将15gC物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为 。
央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。CrO2-是一种酸根离子,则Fe(CrO2)2属于____(填“酸”、“碱”、“盐”或“氧化物”)。明胶的水溶液和K2SO4溶液共同具备的性质是 。
a.都不稳定,密封放置沉淀
b.两者均有丁达尔现象
c.分散质粒子可通过滤纸
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方式: 。
②(CN)2和NaOH溶液反应的离子方程式: 。
(3)已知H2O2是二元弱酸、请写出H2O2与Ca(OH)2溶液反应生成酸式盐的化学式 。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是 。
某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_________,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答下列问题:
(1)Y的最高价氧化物对应水化物的化学式是____________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式____________。
此液体具有的性质是____________(填字母)。
| A.光束通过该液体时形成光亮的“通路” |
| B.插入电极通直流电后,有一极附近液体颜色加深 |
| C.向该液体中加入硝酸银溶液,无沉淀产生 |
| D.将该液体加热、蒸干、灼烧后,有氧化物生成 |
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率__________。
②原无色有刺激性气味的气体与含1.5 mol Y的含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应。可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是(用单线桥表示电子转移方向和数目):_____________________________________________。
(4)室温时,pH=5的HY溶液和pH=5的ZY3溶液中,水电离出的氢离子分别是 mol·L-1和
mol·L-1
Ⅰ.根据条件回答下列问题:
下图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:
(1)该葡萄糖注射液属于分散系中的 (从“溶液”、“胶体”、“浊液”中选择)。
(2)葡萄糖的摩尔质量为 。
(3)已知该葡萄糖注射液的密度是1g/mL,其物质的量浓度为 (列式计算)。
Ⅱ.钠与水反应的过程如下图所示。
请回答:
(1)钠与水反应的化学方程式为 ;
(2)根据②中的实验现象,说明钠的密度比水的 (填“大”或“小”)。
(3)③中滴入酚酞试液后,可观察到溶液变 色。
(4)在实验室中通常将钠保存在 里。
(8分)(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
| A.加入铜粉 | B.加入铁粉 | C.通入氯气 | D.加入KSCN溶液 |
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式
________________________ _______。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式____________ __________________________。
(3)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是_________,区别该液体和FeCl3溶液可用 方法。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是_______________________________________。
有以下几种物质:①食盐晶体 ②铜③KNO3溶液 ④熔融的氢氧化钾 ⑤液态氯化氢。
回答以下问题(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;
(2)以上物质中能导电且属于电解质的是 ;
将1mol/L的FeCl3溶液逐滴滴入沸水中,液体变为 色,得到的是 ;反应的化学方为 。向其中逐滴加入稀硫酸至过量,现象是 ,原因是 。
FeO3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于 (填纯净物或者混合物)。将其加入适量盐酸,反应的化学方程式
(2)用上述所得溶液进行下列实验
取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀产生,反应的离子方程式
(3)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,
继续煮沸至出现 色,即可制得Fe(OH)3胶体。
(4)另取一小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯的液体中产生了丁达尔效应。
(8分)课外活动时间玛丽同学制备Fe(OH)3胶体,具体操作如下:
首先在烧杯中加入25 mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。
试回答下列问题:
(1)写出该反应的化学方程式________________________________________
(2)如何证明玛丽同学是否成功制得胶体?_________________________________________
(3)若玛丽同学在滴加FeCl3饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,为什么呢?_________________________________________________________________
(4)玛丽同学制得的Fe(OH)3胶体中含有少量盐酸,为得到较纯净的胶体,他们设计了以下操作,合理的是____ ____。
A.加入NaOH溶液进行中和
B.加入AgNO3溶液反应后过滤
C.装入半透膜袋中,扎紧袋口,将其全部浸入蒸馏水中,并每隔一段时间,更换一次蒸馏水