如图是A、B、C三种固体物质的溶解度曲线图,请回答:
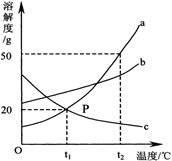
(1)A、B、C三种物质的溶解度受温度影响最大的是 。
(2)P点表示的意义是 。
(3)t2℃时,三种物质的溶解度从大到小的顺序是 。
(4)在t1℃时,将15gC物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为 。
如图是A、B、C三种固体物质的溶解度曲线图,请回答:

(1)A、B、C三种物质的溶解度受温度影响最大的是 。
(2)P点表示的意义是 。
(3)t2℃时,三种物质的溶解度从大到小的顺序是 。
(4)在t1℃时,将15gC物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为 。