阅读下面短文。
光的散射与丁达尔效应
光通过光学性质不均匀的介质时出现偏离原来传播方向,而沿侧向传播的现象,称为光的散射。在暗室里,将一束经聚集后的光线投射到胶体系统上,在与入射光垂直的方向上,可观察到一条明亮的光路,这就是丁达尔效应。产生丁达尔效应的实质是光的散射。
表1 分散系对可见光的不同作用
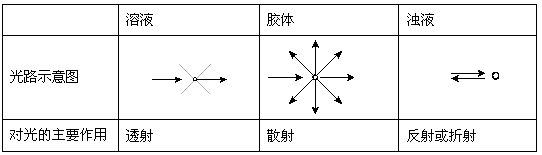
当入射光的波长略大于分散相粒子的直径时就发生光的散射。可见光的波长在400~760 nm的范围,略大于一般胶体粒子的直径(1~100 nm),因此当可见光束投射于胶体时,就发生光的散射,产生丁达尔效应。
对于溶液,分散质分子或离子更小,对可见光的散射作用很微弱;而当可见光束通过浊液时,由于分散质的粒子直径大于入射光的波长,主要发生反射或折射现象。
回答下列问题:
(1)产生丁达尔效应的实质是________________。
(2)制备Fe(OH)3胶体,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入5~6滴饱和的_____________溶液,继续煮沸至液体呈红褐色即可。
(3)胶体区别于其他分散系的本质特征是________(填序号)。
a.胶体有丁达尔效应 b.胶体粒子可以透过滤纸
c.胶体的胶粒带有电荷 d.胶体粒子的直径在1~100 nm之间
(4)CuSO4溶液无明显丁达尔效应的原因是______________________。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
( )两种物质都不是电解质
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色。
①物质M的化学式为______________。
②证明有红褐色胶体生成的实验操作是___________________。
(1)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
①写出反应的离子方程式_____________。
②若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).
(2)有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
①电泳:甲液体的阳极(即接电源正极的一极)周围颜色变浅,阴极(即接电源负极的一极)周围颜色变深;
②将一束光通过乙液体,无丁达尔现象;
③将乙慢慢加入到丙液体中,先出现凝聚,后液体变澄清。
则甲为________,乙为________,丙为________,丁为________。
(1)黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 。
(2)将饱和FeCl3溶液滴入沸水中,继续煮沸至液体变为________色,即可得到Fe(OH)3胶体。向其中逐滴加入稀硫酸至过量,现象是 ,其原因是 。
、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子,制取高铁酸钠的化学方程式如下:
2Fe(NO3)3+16NaOH+3Cl2 = 2Na2FeO4+6NaNO3+6NaCl+8H2O
(1)标出该反应中电子转移的方向和数目。
(2)在上述反应中 (填元素名称)元素被氧化,氧化剂是 (填化学式)。
(3)当有2.408×1024 个电子发生转移时,参加反应的氯气在标准状况下的体积为 。
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂。在水处理过程中,Na2FeO4中的铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,Fe(OH)3胶体中分散质粒子直径的范围是 ,向Fe(OH)3胶体中逐滴加入HCl稀溶液至过量,会出现的现象是: .
现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:

(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是________。
(2)分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
C.两物质都是含碳化合物 d.两物质都是氧化物
(3)上述五种物质中的某相邻两种物质间能发生反应且有离子反应,写出该反应的离子方程式为: ____________________ _____________________。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为_____________。
简要回答下列问题。
(1)鉴别胶体与溶液的最简便方法是 。
(2)常温下,浓硝酸可以用铁质容器密封盛放的原因是 。
(3)3月22日是“世界水日”,水是生命之源,没有水就没有生命。请你提出一种有利于保护水资源的措施: 。
将饱和FeCI3溶液滴入沸水中可以得到的氢氧化铁胶体,请回答下列问题:
(1)该氢氧化铁胶体粒子直径在 之间。
(2)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色 ,这个现象说明 ,胶体的这种性质称为电泳。
(3)向氢氧化铁胶体中滴入过量稀硫酸,现象是
(4)除了以上性质外,氢氧化铁胶体还具有的性质有 。
(5)写出制备氢氧化铁胶体的化学方程式 。
向烧杯中加25mL蒸馏水,加热至沸腾,立即滴加6滴饱和FeCl3溶液,继续煮沸至溶液呈透明红褐色。冷却后将其净化既成功制得介稳体系R。试回答:
(1)R中分散质直径为 ;
(2)煮沸时反应的离子方程式为 ;
(3)判断该实验成功的实验方法是(填名称) ;
(4)向R中逐滴加入稀硫酸至过量,实验现象是 ,最后得到棕黄色溶液。
利用丁达尔效应可以区别溶液与________________。
实验室可以用饱和FeCl3溶液制备Fe(OH)3胶体.
(1)写出制备Fe(OH)3胶体的化学方程式
(2)取烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加稀盐酸至过量,边滴边振荡,可以看到的现象是
食用明胶是水溶性蛋白质混合物,具有很高的营养价值,溶于水形成胶体。而工业明胶中往往含有超标的重金属Cr,从而对人体造成伤害。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成________。
(3)明胶的水溶液和K2SO4溶液共同具备的性质是___________。
a.都不稳定,密封放置沉淀
b.两者均会发生丁达尔效应
c.分散质微粒可通过滤纸
(4)已知胶体的分散质微粒不能透过半透膜,但小分子或离子能透过半透膜。现将10 mL明胶的水溶液与5 mL NaBr溶液混合后装入半透膜袋内,将此半透膜袋浸入盛蒸馏水的烧杯中。若要求只检验一种离子, 就能证明Na+、Br-透过半透膜,写出检验该离子的实验方法:______________________
(5)铬的化合价除了+3和+6价外,还有0,+2,+4和+5价等。现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为____________价。
在①渗析 ②聚沉 ③溶胶 ④凝胶 ⑤布朗运动 ⑥电泳 ⑦丁达尔现象 ⑧中和 ⑨水解 中选出适宜的词语填入下列每小题的空格中(填编号):
(1)肥皂水中透过强光,可以见到光带。这种现象称为_____________________。
(2)在氢氧化铁胶体中加入硫酸,先产生红褐色沉淀后沉淀溶解,这种现象叫做___________________。
(3)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________________。