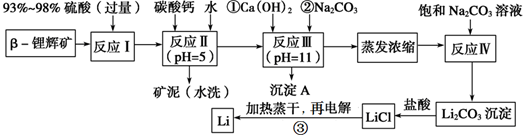
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物
|
Fe(OH)3
|
Al(OH)3
|
Mg(OH)2
|
开始沉淀pH
|
2.7
|
3.7
|
9.6
|
完全沉淀pH
|
3.7
|
4.7
|
11
|
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由 ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al2O3的流程:
(流程常用的表示方式为: )
)