(10 分)已知甲酸铜遇水易水解而具有还原性。实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: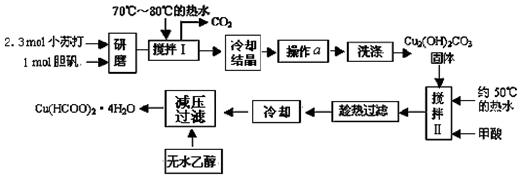
回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称) 中;制备 Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是 。
(2)写出用小苏打、胆矾制备 Cu2(OH)2CO3的离子方程式 ;实际操作中的小苏打与胆矾 的物质的量之比大于 2∶1,原因是 。
(3)操作a 的名称是 。
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是 。
(5)实验中用无水乙醇洗涤产物的目的是 。
味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。
(1)生物硝化法:在富氧条件下,通过硝酸盐菌的作用,将氨氮(以 NH4+表示,下同)氧化成硝酸盐,其反应的离子方程式为 。
(2)MAP 沉淀法:向氨氮废水中投加磷酸盐和镁盐,使之和 NH4+生成难溶复盐MgNH4PO4·6H2O(简称MAP)结晶,是一种比较新颖有效的处理方法。
①用离子方程式表示反应的原理 。
②MAP沉淀法需要控制反应的pH 在 7.5~10 之间。当 pH>10时,由于 而不利于MAP的生成。
(3)电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用 IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为 85 mA·cm-2下电解,180 min内去除率达到98.22%。
①阳极发生的电极反应式是 ; HClO 氧化除去氨氮的反应离子方程式是 。
②为了提高氨氮的去除率,需要控制溶液中 Cl-的浓度和 pH,根据下图判断: Cl-的适宜浓度为 ,适宜的 pH 为 。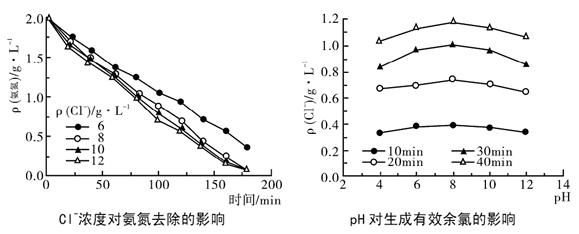
某溶液中可能含有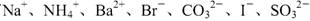 。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
| A.溶液中一定存在Na+、I-、CO32- |
| B.溶液中一定不存在的只有I-、SO32- |
| C.只需再进行一个实验,就可完全确定溶液的组成 |
| D.溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
【化学──选修5:有机化学】
历史上曾将一类从植物胶中取得的具有芳香气味的物质称为芳香族化合物,芳香族化合物大部分具有“芳香性”,有研究者设计利用其特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已略):
已知:
试回答下列问题:
(1)原料A的结构简式为 ;原料B发生反应④所需的条件为 。
(2)D的分子式为 ;F分子中含氧官能团的名称为 、 。
(3)反应①、⑥所属的反应类型分别为 、 。
(4)反应②、⑤的化学方程式分别为②______________;⑤______________。
(5)对苯二甲酸有多种同分异构体,符合下列条件的同分异构体有 种,
①苯环上有三个取代基;②能与NaHCO3溶液发生反应;③能发生银镜反应。
写出其中一个同分异构体发生银镜反应并酸化以后的产物的核磁共振氢谱为四组峰,且峰面积比为1:2:2:1的同分异构体的结构简式 。
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。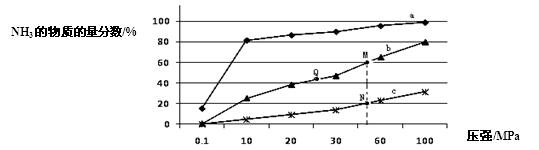
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
下列说法正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,
则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)< c(H2A)
C.室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+ 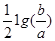
D.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
能正确表示下列反应的离子方程式
| A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO32- |
| B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ |
| D.NaHCO3溶液与稀H2SO4反应:CO32-+ 2H+ = H2O + CO2↑ |
下图是合成有机高分子材料W的流程图:
已知:
回答下列问题:
(1)A的结构简式:____ ____;
(2)C中所含官能团的结构简式: ;
(3) 的名称为_ _____ __;
的名称为_ _____ __;
(4)B→C反应类型为_ _____ __;
(5)写出下列反应的化学方程式:
A→B:________ ____ _____________;
D+E→W:___________ ______________;
B与新制氢氧化铜:___________ ______________;
(6)满足以下条件的E的同分异构体有 种。
①遇FeCl3溶液显紫色 ②可发生银镜反应 ③可与NaHCO3溶液生成CO2
在压强为0.1 MPa、10L恒容的密闭容器中,将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g) CH3OH(g) ΔH<0请回答下列问题:
CH3OH(g) ΔH<0请回答下列问题:
(1)①该反应的熵变ΔS 0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1) K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是 ;
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为 mol;
②反应的平衡常数K= ;
③反应在0-5min区间的平均反应速率v(H2)= 。
氯气与金属锡在加热时反应可以用来制备SnCl4 。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。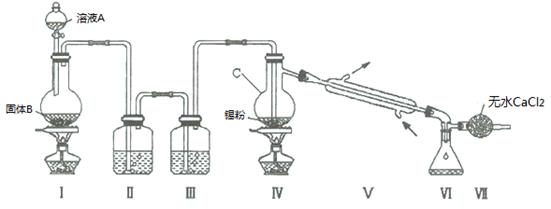
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)该装置存在的缺陷是: ;
(5)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到24.8 g SnCl4 ,则SnCl4 的产率为 。
某溶液中可能含有OH—、CO32—、AlO2—、SiO32—、SO42—、HCO3—、Na+、Fe3+、Mg2+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
| A.原溶液中一定含有Na2SO4 |
| B.反应最后形成的溶液中的溶质只有NaCl |
| C.原溶液中一定含有的阴离子是:OH—、SiO32—、AlO2—、CO32— |
| D.原溶液中含有CO32- 与AlO2-的物质的量之比为1∶2 |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
(14分)还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)===2NO(g);ΔH=+180.6 kJ·mol-1
C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1
反应C(s)+2NO(g)===CO2(g)+N2(g);ΔH=________kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH===HNO3。写出OH与NO反应的化学方程式:___________。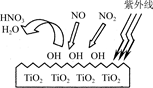
(3)下图所示的装置能吸收和转化NO2、NO和SO2。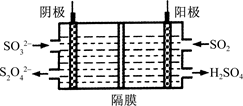
①阳极区的电极反应式为____。
②阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。将S2O42-吸收NO2的离子方程式配平,并在方格内填上相应物质:____S2O42-+____NO2+____OH-===SO32-+____N2+____
③已知阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为________。
(4)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________。
(15分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是____。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有________(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:______。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________时,停止加热,将烧瓶取下;
④________________________________;
⑤________________________________;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
(12分)次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:① 准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.582 5 g。次硫酸氢钠甲醛和碘反应的方程式如下:
xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。