下列离子方程式正确的是
A.0.01mol NH4Al(SO4)2溶液与0.01mol·L-1Ba(OH)2溶液等体积混合 +Al3++2 +Al3++2 +2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O +2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
B.Na2S2O3溶液中加入稀硫酸: +4H+= +4H+= +3S↓+2H2O +3S↓+2H2O |
| C.将标准状况下的11.2L氯气通入200mL2mol·L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
D.铁粉中滴加少量浓硝酸:Fe+3 +6H+=Fe3++3NO2↑+3H2O +6H+=Fe3++3NO2↑+3H2O |
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为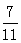 ,则SO2的转化率为 。
,则SO2的转化率为 。
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因 。
(2)乙认为上述现象只能说明混合气体具有 性,实验中使试纸变蓝的气体单质还可能是 。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有 溶液的洗气瓶中,若现象为 ,则甲的推测合理。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
② 反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3和MnO2混合于试管中,加热, 。写出历程中反应②的化学方程式 。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为 。
醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。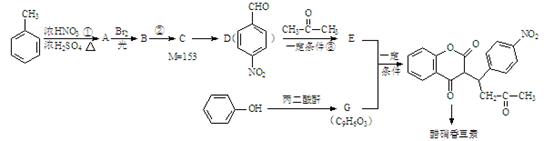
已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 。
(2)从A到B引入的官能团名称是 。
(3)反应②的化学方程式为 。
(4)反应③的化学方程式为 。
(5)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应;②可与碳酸氢钠溶液反应生成二氧化碳气体。其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
下述实验方案不能达到实验目的的是
| 编号 |
A |
B |
C |
D |
| 实验 方案 |
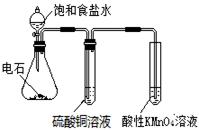 |
 |
 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
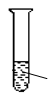 2mL0.1mol·L-1NaCl溶液 ① 加入3滴同浓度的AgNO3溶液再加入3滴同浓度的Na2S溶液 |
| 目的 |
验证乙炔的还原性 |
收集氨气 |
验证Fe电极被保护 |
验证AgCl的溶解度 大于Ag2S |
下列说法不正确的是
| A.银氨溶液可以用于区分麦芽糖和蔗糖 |
| B.乙醇、乙二醇、丙三醇的沸点依次升高 |
C.1mol乙酰水杨酸( )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 |
D.可用 和HCHO为原料合成 和HCHO为原料合成 |
选做【化学——有机化学基础】对羟基苯甲酸甲酯主要用作食品、化妆品、医药的杀菌防腐剂,以有机物M(分子式C9H10O2)为原料合成路线如下,其中E与 有图中所示转化关系(无机产物略):
有图中所示转化关系(无机产物略):
已知:当羟基与双键碳原子相连时,易发生转化RCH=CHOH RCH2CHO。
RCH2CHO。
请回答下列问题:
(1)B与F中具有相同的官能团,检验该官能团的试剂是 。上述变化中属于取代反应的是 (填反应编号)。
(2)写出结构简式M ,A 。
(3)写出下列反应的化学方程式:
反应⑤ ;D与碳酸氢钠溶液反应 。
(4)写出同时符合下列要求的M的同分异构体的结构简式 。
Ⅰ.含有苯环,且苯环上的一氯取代产物有3种
Ⅱ.能发生银镜反应和水解反应
Ⅲ.在稀氢氧化钠溶液中,1mol该同分异构体能与1molNaOH反应
室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是
| A.该一元酸溶液浓度为0.10mol/L |
| B.a、b、c点的水溶液导电性依次增强 |
C.室温时,HA的电离常数Ka l×10-5 l×10-5 |
| D.a点和c点所示溶液中H2O的电离程度相同 |
关于甲、乙装置的下列叙述中正确的是
| A.甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动 |
| B.C电极的电极反应为:O2+4e-+4H+==2H2O |
C.乙池中的总反应为:Cu+H2SO4 H2 H2 +CuSO4 +CuSO4 |
| D.反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
下述实验操作不能达到实验目的的是
| 编号 |
实验目的 |
实验操作 |
| A |
验证SO2具有漂白性 |
将SO2通入品红溶液中,品红溶液褪色 |
| B |
验证Fe2+的还原性 |
FeCl2溶液中加入酸性KMnO4溶液,KMnO4溶液褪色 |
| C |
检验尿液中是否含有葡萄糖 |
在尿液中加新制的Cu(OH)2悬浊液加热至沸腾 |
| D |
验证Na2CO3溶液中存在水解平衡 |
在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
选做(12分)【化学-有机化学基础】
下列为合成聚合物F的路线图:

请根据以上信息,回答下列问题:
(1)A中含有官能团(不考虑苯环,下同)名称是_________,C的系统命名为_________。
(2)B+D→E的反应类型是__________,检验B中所含官能团所用的试剂有_______。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________。
(4)G物质的相对分子质量比 的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
的相对分子质量大2,则符合下列条件的G的同分异构体有____种。
①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O  CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
(1)A装置为加热分解草酸的装置,该装置错误是_________________,C装置中盛放的试剂是_______ (填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:
①点燃A处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。
这4步操作由先到后的顺序为_______(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 |
0.01mol/L KMnO4 |
0.1mol/L H2C2O4 |
0.1mol/L H2SO4 |
MnSO4固体 |
| 甲 |
4 mL |
x mL |
1 mL |
无 |
| 乙 |
y mL |
2mL |
1 mL |
有 |
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是___________________。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
按要求回答下列问题
(1) 第②步操作中,氧化性强弱顺序:ClO3-______ MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:__________。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是______(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
将E 和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)  2G(g)。
2G(g)。
若忽略固体体积,平衡时 G 的体积分数随温度和压强的变化如下表所示。请填写下列空格:
(1)表中数据b f。(选填“>”、“<”或“=”)
(2)该反应的熵变ΔS 0,ΔH 0。(选填“>”、“<”或“=”)
(3)根据表中数据,可计算求得915℃、2.0MPa时E 的转化率为 。
(4)上述反应达到平衡后,若保持体系温度不变,下列措施中能提高混合体系中气体E的体积分数的是
| A.保持容器容积不变,充入一定量的气体 E |
| B.保持容器内压强不变,充入一定量的气体 G |
| C.加入少量固体F的粉末 |
| D.保持容器容积不变,同时充入一定量的气体 E 和G |