(15分)兔耳草醛是一种人造香料,它的合成路线如下:
(1)反应①~④中属于加成反应的是_____(填序号),化合物E中的官能团的名称是_____。
(2)反应②中若HCHO过量,则D可继续与HCHO反应生成________(填结构简式)。
(3)写出同时满足下列条件的D的同分异构体的结构简式:________________。
Ⅰ.既能发生水解反应,也能发生银镜反应;Ⅱ.分子中有3种不同化学环境的氢。
(4)写出物质D在Cu作催化剂条件下与氧气反应的化学方程式:________________。
(5)已知: 。写出以物质C为原料制备聚乳酸
。写出以物质C为原料制备聚乳酸 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2OH CH2CH2
CH2CH2 CH3CH3
CH3CH3
(12分)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为____。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:____。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是____。
(4)本流程中可以循环利用的物质除锌外还有________。
向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同温度下,发生反应:A(g)+B(g)  xC(g);ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是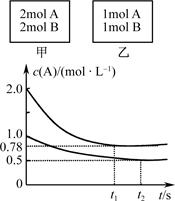
A.x不可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
下列离子方程式与所述事实相符且正确的是
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| B.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
【化学——选修5:有机化学基础】
已知:RCH2COOH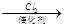 RCHClCOOH RONa
RCHClCOOH RONa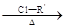 ROR′ (R—,R′—代表烃基)
ROR′ (R—,R′—代表烃基)
为合成具有菠萝香气食用香料的菠萝酯,合成途径如下: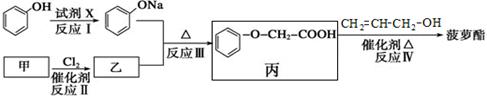
(1)常温下,下列物质能与菠萝酯发生反应的有___ _(填序号)。
a.苯 b.Br2/CC14 c.银氨溶液 d.KMnO4/H+溶液
(2)乙中的官能团名称是 ,反应III的反应类型为 。
(3)反应II中乙的结构简式为
(4)反应I中试剂X可选用的试剂是 (任写一种名称)。
(5)写出乙跟氢氧化钠水溶液反应的化学方程式 。
(6)丙有多种酯类的同分异构体,其中的Y具有如下特点:
a.能与FeCl3溶液发生显色反应,
b.苯环上有2种一硝基取代物
写出任意1种Y的结构简式: 。
【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式 。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B(填“>”、“<”)
(5)BBr3分子中,键角为 ,为 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是。
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
(1)已知t ℃时AgCl的Ksp=2×10-10;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是。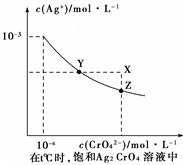
| A.在t ℃时,Ag2CrO4的Ksp为1×10-9 |
| B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点 |
| C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃时,AgCl的溶解度大于Ag2CrO4 |
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是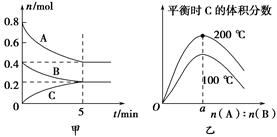
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
[化学——选修5:有机化学基础](15分)
邻苯二甲酸二乙酯 是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: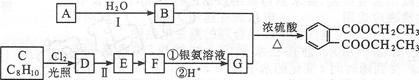
已知以下信息:①有机化合物A可用来催熟水果。
②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
(1)A的化学名称是 。
(2)B的结构简式为 。
(3)C生成D的化学方程式为 。
(4)反应Ⅱ的试剂是 ,该反应类型为 。
(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有 种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同” “不相同”)。
(15分)甲醇是重要的化工原料,在化工生产中有广泛的应用。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH。写出相应反应的化学方程式: 。
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇。已知:
光催化制氢:2H20(1)=2H2(g)+O2(g)  H=+571.5 kJ·mol-1
H=+571.5 kJ·mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H20(1)  H= 一137.8 kJ·mol-1
H= 一137.8 kJ·mol-1
则反应:2H2O(1)+C02(g)=CH30H(l)+3/202(g)的 H= kJ·mol-1
H= kJ·mol-1
(3)已知反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H=Q
H=Q
在20 L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195 ℃时n(H2)随时间的变化如表所示。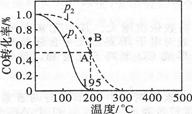

①O~3 min,平均速率V(CH3OH)= ,Q 0(填“<”“=”或“>”)。
②图中压强(P1、P2)的大小顺序为 ,理由是 。
③在P2及195 ℃时,该反应的平衡常数K= 。
(14分)亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多。回答下列问题:
(1)亚硝酸是一种中强酸,写出其电离方程式 。
(2)HNO2及NaN02均可将溶液中的I-氧化为I2,这个反应可用于分析测定。
①HNO2中,N元素的化合价为 。
②在酸性条件下,NaN02与KI按物质的量之比l:1恰好完全反应,含氮产物为 (填化学式)。
③要得到稳定的HN02溶液,可以往冷的浓NaN02溶液中加入或通入某种物质,下列物质中不适合使用的
是 (填序号)。
a.磷酸
b.二氧化碳
c.稀硫酸
d.二氧化硫
e.次氯酸
(3)HNO2的工业制法是:将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液。写出该反应的化学方程式: 。
(4)亚硝酸盐对人体健康的损害不亚于农药。可采用电解法除去。电解含Ce3+、NO2- 的废水除去NO2- ,其次是再生Ce4+,其原理如图所示。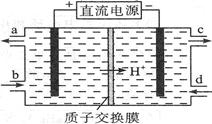
①Ce4+从电解槽的 (填字母序号)口流出。
②写出阴极的电极反应式 。
(14分)(1)实验室用锌片和稀硫酸反应制取氢气.并验证氢气的还原性及回收硫酸锌晶体。
①若用上述各仪器,则各仪器的连接顺序为 ,装置E中盛放的试剂为 ,C装置的作用是 。
②锌与硫酸反应制取氢气后的溶液中。常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从适量BaCl2溶液、适量Zn粉、适量NaOH溶液三种试剂中选用一种试剂除杂,该试剂为 。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H20的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7 6.5 9.7 。
①为了提高酸浸效率,可以采取的措施有 。
②加入适量锌粉的作用为 。
③氧化过程中加人H202发生反应的离子方程式为 。
④由滤液得到ZnS04·7H2O的操作依次为 、 、过滤、洗涤、干燥。
已知25 ℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.O×10一16。下列说法正确的是
| A.25 ℃时,O.1 mol·L-1 HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 |
| B.向1 L0.2 mol·L-1 HF溶液中加入1 L O.2 mol·L-1 CaCl2溶液,没有沉淀产生 |
| C.AgCl不溶于水,不能转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 mol·L-1 mol·L-1 |