北京市海淀区高三年级3月适应性训练理综化学试卷
化学与社会、生产、生活密切相关,下列说法正确的是
| A.PM2.5中含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
| B.柠檬在味觉上有酸味,是酸性食物 |
| C.氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 |
| D.“地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 |
与下列事实对应的化学用语不正确的是
A.用热的纯碱溶液可以清洗油污:CO32- +H2O HCO3- + OH- HCO3- + OH- |
| B.配制FeSO4 溶液时加入适量的铁粉:Fe3+ + Fe == 2Fe2+ |
C.向NH4HSO4溶液中加过量的NaOH溶液并加热:NH4+ + H+ + 2OH- NH3↑ + 2H2O NH3↑ + 2H2O |
| D.铝片溶于较浓的NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O ="=" 2AlO2-+ 3H2↑ |
依据下图判断,下列说法正确的是
| A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 |
| B.氢气的燃烧热为△H =" -241.8" kJ·mol-1 |
| C.液态水分解的热化学方程式为:2H2O(l) ="=" 2H2(g) + O2(g)△H =" +571.6" kJ·mol-1 |
| D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
下列说法不正确的是
| A.银氨溶液可以用于区分麦芽糖和蔗糖 |
| B.乙醇、乙二醇、丙三醇的沸点依次升高 |
C.1mol乙酰水杨酸( )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 |
D.可用 和HCHO为原料合成 和HCHO为原料合成 |
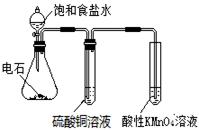
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是
| A.a 连接电源的正极 |
| B.Li+ 的移动方向是从海水进入到盐酸中 |
| C.过程中还可能获得有经济价值的副产物氢气和氯气 |
| D.一段时间后,b电极附近溶液的pH降低 |
下述实验方案不能达到实验目的的是
| 编号 |
A |
B |
C |
D |
| 实验 方案 |
 |
 |
 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
 2mL0.1mol·L-1NaCl溶液 ① 加入3滴同浓度的AgNO3溶液再加入3滴同浓度的Na2S溶液 |
| 目的 |
验证乙炔的还原性 |
收集氨气 |
验证Fe电极被保护 |
验证AgCl的溶解度 大于Ag2S |
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
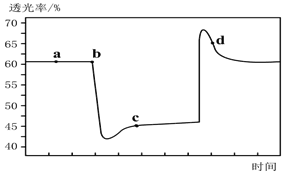
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| D.d 点:v(正)>v(逆) |
醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。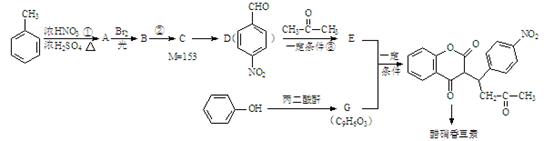
已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 。
(2)从A到B引入的官能团名称是 。
(3)反应②的化学方程式为 。
(4)反应③的化学方程式为 。
(5)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应;②可与碳酸氢钠溶液反应生成二氧化碳气体。其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因 。
(2)乙认为上述现象只能说明混合气体具有 性,实验中使试纸变蓝的气体单质还可能是 。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有 溶液的洗气瓶中,若现象为 ,则甲的推测合理。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
② 反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3和MnO2混合于试管中,加热, 。写出历程中反应②的化学方程式 。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为 。
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为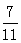 ,则SO2的转化率为 。
,则SO2的转化率为 。
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下图: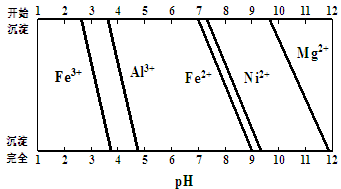
(1)滤渣1的主要成分为 。
(2)电解脱铜:金属铜在 极析出。
(3)①用离子方程式解释加入H2O2的作用 。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。
(4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下: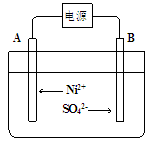
①A极的电极反应式为 和2H++2e-=H2↑。
②B极附近pH会 (填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因: 。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号