铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
铁是用途最广泛的金属材料之一,但生铁易生锈,请讨论电化学实验中有关铁的性质。
(1)某原电池装置如图所示,右侧烧杯中的电极反应为_________,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。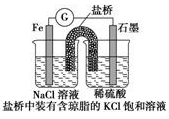
(2)已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(3)用高铁酸盐设计的高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式________________________________。
②用高铁电池做电源,以铁为阳极,以铜作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________L。(标准状况)
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

已知反应2NO2(g) N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
|
|
0.08 |
0.08 |
下列分析合理的是( )
A.从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的
B.80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅
C.n1的范围是0.28<n1<0.33
D.升高温度,既能加快反应速率,也能提高N2O4的体积分数
已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A.V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) |
| B.V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) |
| C.V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) |
| D.对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)__________0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_________mol/L。
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH_______。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 |
0.1032mol/LHCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
25.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为_________mol/L。(保留四位有效数字)。
②下列情况可能引起测定结果偏高的是__________。
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________。
A.KI B.K2CrO4 C.KBr D.K2S
A、B、C、D、E五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是__________,(填化学式,下同)E是__________;
(2)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中__________曲线(填写序号).
(3)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为__________.
(4)写出C的稀溶液和足量的D溶液反应的离子方程式______________________。
工业制备氯化铜时,将浓盐酸用蒸汽加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得到强酸性的混合溶液。现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全沉淀;pH≥6.4时,Cu2+完全沉淀;pH≥3.7时,Fe3+沉淀。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?_______(填“能”或“不能”),理由是________。
(2)有人用强氧化剂Ca(ClO)2将Fe2+氧化为Fe3+:
①加入Ca(ClO)2后,溶液的pH变化是_______(填代号)。
| A.可能减小 | B.一定减小 | C.可能增大 | D.一定增大 |
②你认为用Ca(ClO)2做氧化剂是否妥当?________,理由是______________________。
③现有下列几种常用的氧化剂,适合用于除去混合溶液中Fe2+的有______(有几个选几个,填代号)。
A Cl2 B KMnO4 C 浓HNO3 D O2 E H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(有几个选几个,填代号)。
A Cu2(OH)2CO3 B 氨气 C CuO D Na2CO3 E NaOH F Cu(OH)2
两只密闭容器A和B,A保持温度、容积不变;B保持温度、压强不变。起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;向左、向右、不移动;增大、减小、不变)。
(1)达到平衡所需要的时间:t(A)_________t(B),SO2的转化率:a(A)________a(B)
(2)起始时两容器中的反应速率:v(A)________v(B),反应过程中的反应速率:v(A)________v(B)。
(3)达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向________反应方向移动,B中的化学反应速率________。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量________,B容器中SO2的百分含量________。
按要求填写下列相关内容:
(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性。如果a+b=15,则Va:Vb=___________。某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=___________。
(2)中和相同体积,相同pH的Ba(OH)2、NH3·H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸。
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是___________。(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_____________。
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是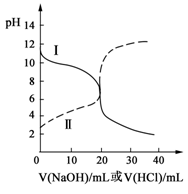
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是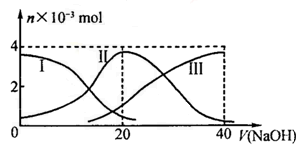
| A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| B.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸 |
| D.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是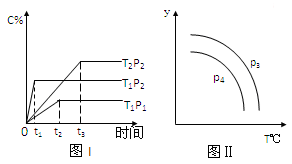
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )

| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
下列离子方程式正确的是
| A.向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-=I2+4Br-+2Fe3+ |
| B.向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg=4Cu+2Ag+5Mg2+ |
| C.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| D.向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液: |
2HSO3-+4ClO-=2SO42-+2Cl-+2HClO