下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
SO2和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
CuSO4可以用作游泳池消毒剂 |
铜盐能使蛋白质变性 |
| C |
盐酸和氨水能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
| D |
用淀粉-KI溶液鉴别FeCl2 |
Fe2+有氧化性 |
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
固体NH5属离子化合物。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水作氧化剂 |
| B.NH5中N元素的化合价为+5价 |
| C.1 mol NH5中含有5NA个N—H键 |
| D.与乙醇反应时,NH5被还原 |
利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如下图。下列有关利尿酸的说法中正确的是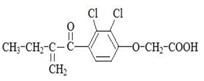
| A.分子式是C13H14O4Cl2 |
| B.1mol利尿酸最多能与5mol H2发生加成反应 |
| C.一定条件下能发生加聚、缩聚反应 |
| D.分子中所有碳原子不可能共平面 |
设NA为的值。下列说法正确的是
| A.0.lmol过氧化钠中,阴阳离子总数为0.4 NA |
| B.11.2L氯气通入足量的水中充分反应,转移的电子数目为0.5 NA |
| C.42g乙烯与丙烯的混合气体含碳原子数目为3 NA |
| D.1L 0.lmol/L氨水中,OH-数目为0.1 NA[来 |
常温下,下列各组离子或分子在指定溶液中能大量共存的是
| A.pH=l的溶液中:Fe2+、Na+、SO42-、NO3- |
| B.水电离的c(H+)=l×l0-13mol/L的溶液中:NH4+、K+、Cl-、HCO3- |
| C.KMnO4溶液中:H+、Na+、SO42-、C2H5OH |
| D.使甲基橙变红色的溶液中:NH4+、Al3+、NO3-、Cl- |
下表中关于物质分类的正确组合是
| 类别组合 |
酸性氧化物 |
碱性氧化物 |
电解质 |
强电解质 |
高分子物质 |
| A |
CO2 |
CuO |
氨气 |
NH3·H2O |
葡萄糖 |
| B |
SO3 |
Na2O |
稀硫酸 |
NaOH |
果糖 |
| C |
SO2 |
CaO |
冰醋酸 |
KOH |
纤维素 |
| D |
N2O5 |
Na2O2[ |
α-丙氨酸 |
Cu(OH)2 |
聚乙烯 |
硝矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O及少量氧化铁。
利用明矾石制备K2SO4的工艺流程如下所示:

(1)焙烧炉中发生如下反应,请用双线桥法在方程式中表示出电子转移的方向和数目
2Al2(SO4)3+3S 2Al2O3+9SO2↑
2Al2O3+9SO2↑
(2)步骤②涉及Al2O3的离子方程式为 。
(3)步骤③调pH生成AI{OH)。的离子方程式为 ;不能用CO2来调pH,理由是 。
(4)步骤④的主要操作步骤是 ,过滤、洗涤和干燥
本题包含两部分.请分别作答:
(Ⅰ).NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题
(1)NO的危害在于
a.破坏臭氧层
b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合
d.当它转化为N2后使空气中O2含量降低
(2)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为 。
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是______________ 。
(Ⅱ).1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。

则该溶液中确定含有的离子有 ;肯定不含有的离子有 ,
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n (Cl-) |
1.25mol |
1.5mol |
2mol |
| n (Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ,a= 。
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 。
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| |
操作 |
现象 |
结论 |
| A |
无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| B |
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 |
出现白色沉淀 |
溶液X中一定含有SO42- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是
| A.NO2 | B.SO2 | C.SO3 | D.CO2 |
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同,且SO42-的物质的量浓度为6mol•L-1,则此溶液最多溶解铁粉的质量为
| A.11.2g | B.14.0g | C.22.4g | D.33.6g |
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑤检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液
| A.①②③ | B.②③④ | C.③④ | D.③ |