山西省晋中市四校高三上学期期中联考化学试卷
黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是
| A.加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 |
| B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| C.用细菌与酶的扩充法去除水中的氨氮的方法属于生物法 |
| D.用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
固体NH5属离子化合物。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水作氧化剂 |
| B.NH5中N元素的化合价为+5价 |
| C.1 mol NH5中含有5NA个N—H键 |
| D.与乙醇反应时,NH5被还原 |
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
某学生鉴定甲盐的流程如图所示,下列说法正确的是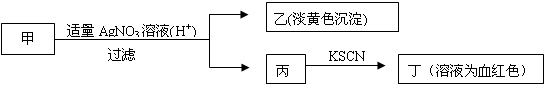
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素。可能显示+2或者+3价 |
下列陈述I、II正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
SO2和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
CuSO4可以用作游泳池消毒剂 |
铜盐能使蛋白质变性 |
| C |
盐酸和氨水能溶解Al(OH)3 |
Al(OH)3是两性氢氧化物 |
| D |
用淀粉-KI溶液鉴别FeCl2 |
Fe2+有氧化性 |
四种短周期元素在周期表中的位置如右图,其中只有M元素原子最外层电子数与电子 层数相等,下列说法不正确的是
| |
|
Y |
Z |
| M |
X |
|
|
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应水化物的酸性比X的弱
下列实验现象预测正确的是
| A.实验Ⅰ:振荡后静止,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但颜色无变化 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:煮沸溶液至红褐色,停止加热,光束通过体系时产生丁达尔效应 |
能正确表示下列反应的离子方程式是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 (s) + 2Fe3+(aq)= 2Fe(OH)3 (s) + 3Mg2+(aq) |
| B.钠与CuSO4溶液反应:2Na + Cu2+ =" Cu↓" + 2Na+ |
| C.已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+ CO2(少量) + H2O=CO32-+ 2HClO |
| D.将足量的NaHCO3溶液加入少量澄清石灰水中:Ca2+ + OH- + HCO3-=CaCO3↓+ H2O |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下,92 g的NO2和N2 O4混合气体中含有原子数为6 NA |
| B.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2 L |
| C.0.25 mol Na2O2中含有的阴离子数为0.5NA |
| D.在反应KIO3 +6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是
| A.原溶液一定含有Na2SO4 |
| B.反应最后形成的溶液中的溶质为NaCl |
| C.原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32- |
| D.原溶液中含有CO32-与AlO2-的物质的量之比为1∶1 |
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是
A. Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
| B.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑ |
| C.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| D.工业上金属铈一般保存在敞口容器中 |
向含SO32-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是

CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气为0.16 mol |
| B.n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl): n(NaClO): n(NaClO3)可能为11:2:1 |
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为______ ____,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________。

(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________,____________。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。

(1)B必须放在冰水浴中控制温度,其原因是 。
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

① Ⅱ中反应的离子方程式是 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式 。
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量 。(填“相同”,“不同”或“无法判断”)
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:

(1)单质B的结构式:_____ ____。
(2)F元素周期表中的位置:_____ _____。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。均含有D元素的乙与丁在溶液中发生反应的离子方程式_______ 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34。其中庚的熔沸点比辛_________(填“高”或“低”),原因是___________________。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ 。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。______________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式___________________________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 _;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是____ _。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:____________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号