已知水在25℃和95℃时,其电离平衡曲线如右图所示,下列说法错误的是
| A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L |
| B.15℃时,pH=7的溶液呈酸性 |
| C.AB连线上的点均表示中性溶液 |
| D.B点对应的温度高于A点对应的温度 |
上图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述错误的是
A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH =-92kJ·mol-1 2NH3(g) ΔH =-92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
上图为某化学反应的速率与时间的关系示意图。在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是

A.2SO2(g)+O2(g)  2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
对室温下100 mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 |
| B.温度都升高20 ℃后,两溶液的pH不再相等 |
| C.加水稀释至溶液体积为200 mL后,醋酸的电离度减小,电离平衡常数也减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |
一定温度下,两个恒容密闭容器中分别发生反应:
①H2(g)+I2(g) 2HI(g);
2HI(g);
②C(s)+H2O(g) CO(g)+H2(g),
CO(g)+H2(g),
下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;b.容器内气体压强不变;c.容器内气体密度不变;d.容器内气体颜色不变;e.各组分的物质的量分数或质量分数不变;f.混合气体的平均分子量不变;
| A.ae | B.aef | C.abc | D.ac |
已知热化学方程式:aX(g)+3Y(g) bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
| A.800 | B.5/4 |
| C.35 | D.20 |
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:A(g)+2B(g) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)
A.cB= |
B.cB= |
C.cB= |
D.cB= |
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中所有粒子的浓度都减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mL pH=11的NaOH溶液,混合液pH=7 |
在25℃时,用0.125 mol·L-1的标准盐酸溶液滴定25.00 mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为
| A.13 | B.12 | C.10 | D.11 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
在指定环境中可能大量共存的离子组是
| A.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
| B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+ NO3- Na+ SO42- |
| C.使甲基橙变红的溶液中:NH4+、K+、ClO-、Cl- |
| D.能与Al反应放出H2的溶液中:K+、Cu2+、Cl-、NO3- |
已知2SO2(g) + O2(g) 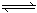 2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若降低温度,可以减慢反应速率 |
| B.催化剂虽然能加快化学反应速率,但不能提高SO2的转化率 |
| C.氧气足量时,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2和SO3的浓度一定相等 |
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。