设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
| B.常温常压下,18 g H2O 中含有的原子总数为3NA |
| C.标准状况下,11.2 L 乙醇中含有的分子数目为0.5NA |
| D.常温常压下,2.24 L CO 和CO2混合气体中含有的碳原子数目为0.1NA |
下列叙述正确的是
| A.由同种元素组成的物质肯定是纯净物 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.含有金属元素的离子一定都是阳离子 |
| D.两种原子若核外电子排布相同,则一定属于同种元素 |
下列实验操作中,所用仪器合理的是
| A.用25mL的烧杯量取14.80mL NaOH溶液 |
| B.用100mL的量筒量取5.2mL的盐酸 |
| C.用托盘天平称取25.20g NaCl |
| D.用100mL容量瓶配制80mL 0.1mol/L的盐酸 |
下列各溶液中,Na+物质的量浓度最大的是
| A.4.0L 0.5mol·L-1NaCl溶液 |
| B.1.0L 0.3mol·L-1Na2SO4溶液 |
| C.5.0L 0.4mol·L-1NaOH |
| D.2L 0.15mol·L-1Na3PO4 |
小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为
| A.分解反应、2个 |
| B.化合反应、3个 |
| C.复分解反应、1个 |
| D.置换反应、2个 |
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1
的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在的所有电离平衡为_____________________________(用电离方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
 容器体积 容器体积温度 |
1 |
2 |
4 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20[ |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.温度不变,压强增大,Y的质量分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
HM和HR的溶液分别加水稀释时pH变化如下图。下列叙述中正确的是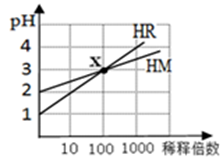
| A.HR可能是弱酸 |
| B.x点时c(R-)=c(M-) |
| C.HM是一种强酸 |
| D.稀释前,c(HR)=10c(HM) |
常温下,某未知溶液中c(H+)/c(OH-)=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检验就能加以否定的离子是
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(L·min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L