金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是
| A.工业上金属Mg、Al都是用电解熔融的氯化物制得的 |
| B.合金的性质与其成分金属的性质不完全相同 |
| C.金属冶炼的本质是金属阳离子得到电子变成金属原子 |
| D.越活泼的金属越难冶炼 |
如表为某有机物与各种试剂的反应现象,则这种有机物可能是
| 试剂 |
钠 |
溴水 |
NaHCO3溶液 |
| 现象 |
放出气体 |
褪色 |
放出气体 |
A.CH2═CH﹣CH2﹣OH B.
C.CH2═CH﹣COOH D.CH3COOH
已知:CH3CH2OH+NaBr+H2SO4(浓) CH3CH2Br+NaHSO4+H2O.
CH3CH2Br+NaHSO4+H2O.
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:

①按图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应.
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为 .
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是 .
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色.将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取 (填“上层”或“下层”)液体.为了除去其中的杂质,可选择下列试剂中的 (填序号).
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行 (填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后 (填序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却.
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
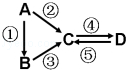
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物.D物质常用于食品工业.写出④反应的化学方程式 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写出③反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.写出④反应的离子方程式 .
下列各组物质按如图所示转化关系每一步都能一步实现的是

| |
甲 |
乙 |
丙 |
丁 |
| A |
FeCl3 |
FeCl2 |
Fe2O3 |
Fe(OH)3 |
| B |
Cu |
CuO |
CuSO4 |
CuCl2 |
| C |
SO2 |
H2SO4 |
SO3 |
H2S |
| D |
Al(OH)3 |
NaAlO2 |
Al2O3 |
AlCl3 |
A.A B.B C.C D.D
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为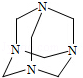
| A.1:1 | B.2:3 | C.3:2 | D.2:1 |
下列说法不正确的是
| A.为了提高生活用水的卫生标准,自来水厂常使用Cl2和FeSO4•7H2O进行消毒、净化,以改善水质 |
| B.硝酸、纯碱、醋酸钾和硅石分别属于酸、碱、盐和氧化物 |
C. 从分类的角度看,混合物、分散系、胶体的从属关系如图所示 |
| D.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的
| A.四种元素中有两种元素在第二周期 |
| B.W所在主族元素的原子次外层电子数可能为2或8,不可能为18 |
| C.X、Y、Z的最高价氧化物对应的水化物两两之间能反应 |
| D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
| A.① | B.④ | C.②③④ | D.①②③ |
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl﹣,则SO42﹣为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.4 mol/L |
根据原子结构及元素周期律的知识,下列推断正确的是
A.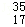 Cl2与 Cl2与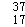 Cl2氧化能力相近,二者互为同位素 Cl2氧化能力相近,二者互为同位素 |
B.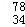 Se与 Se与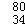 Se所含质子数相同,中子数不同 Se所含质子数相同,中子数不同 |
| C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 |
| D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小 |
设NA为阿伏加德罗常数的数值.下列说法正确的是
| A.1mol甲苯含有6NA个C﹣H键 |
| B.18g H2O含有10NA个质子 |
| C.标准状况下,22.4L氨水含有NA个NH3分子 |
| D.56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
池州八中一化学实验小组在同样的实验条件下,用同样的实验仪器和方法进行两组中和热测定的实验,实验试剂及用量如下表所示。
| 反应物 |
起始温度(0C) |
终了温度 (0C) |
中和热(kJ·mol-1) |
|
| 硫酸 |
碱溶液 |
|||
| ①0.5mol/LH2SO4溶液50ml、 1.1mol/LNaOH溶液50ml |
24.8 |
24.9 |
|
ΔH1 |
| ②0.5mol/LH2SO4溶液50ml、 1.1mol/LNH3·H2O溶液50ml |
24.8 |
24.9 |
|
ΔH2 |
(1)该实验小组所用的主要玻璃仪器有量筒、大小烧杯和 、
(2)实验①、②中碱液过量的目的是
(3)上表中需要测定的终了温度是
(4)该实验小组中一同学预计ΔH1≠ΔH2 ,其依据是
实验小组通过测定,实验①中放出的热量约为2.84KJ,则ΔH1=
(5)若实验①中硫酸用等体积、等浓度的盐酸代替,不考虑中和反应时HCl的挥发,则测得中和反应过程中放出的热量Q (填“偏大”、“偏小”或“不变”,下同),测得的中和热ΔH 。