反应Cu(s)+2Ag+(aq) Cu2+(aq)+2Ag(s)设计成如图所示原电池,下列叙述正确的是
Cu2+(aq)+2Ag(s)设计成如图所示原电池,下列叙述正确的是
| A.KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B.Ag作负极,Cu作正极 |
| C.工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D.取出盐桥后,电流计的指针依然发生偏转 |
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)  MnO(s) + CO2(g) ②2MnO(s) + O2(g)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
| A.平衡常数减小 | B.MnCO3质量不变 | C.CO2压强不变 | D.MnCO3物质的量增加 |
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
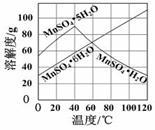
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O ="=" 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
已知Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物。下列叙述中不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.Fe3+属于反应物, Fe2+属于生成物 |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-= Fe3+ |
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为______________________。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2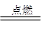 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______________________。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。
Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。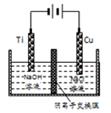
锌铜原电池(如图)工作时,下列叙述正确的是
| A.正极反应为Zn – 2e- = Zn2+ |
| B.电池总反应为Zn+Cu2+= Zn2++ Cu |
| C.取出盐桥,电流表指针仍然偏转 |
| D.盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
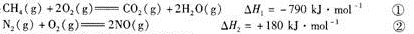
CH4可用于脱硝,其热化学方程式为:

已知反应①中的相关的化学键键能数据如下:

由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。

(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
锌铜原电池装置如图所示,其中阴离子交换膜只允许阴离子和水分子通过,下列有关叙述正确的是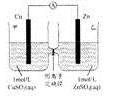
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池溶液的总质量增加 |
| C.电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) |
| D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
下列说法不正确的是( )
| A.为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 |
| B.原电池工作时,电流的方向由正极→负载→负极→原电池中电解质→正极 |
| C.白铁(镀锌铁)镀层破损后一段时间内,铁皮依然受到保护 |
| D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
在右图所示的原电池中,下列说法正确的是( )

A.正极反应为 Cu - 2e-  Cu2+ Cu2+ |
| B.溶液中H+向锌片移动 |
| C.电子由锌片通过导线流向铜 |
| D.该装置能将电能转化为化学能 |
Ⅰ已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ•mol-1
②H2O(l)═H2O(g) △H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式: 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断⑴中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH) = 3v逆(H2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④CH3OH、H2O、CO2、H2的浓度都不再发生变化
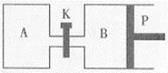
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:
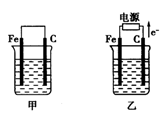
(1)若两池中均盛放CuSO4溶液,甲池中石墨棒上的电极反应式为____________________.
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为:

下列说法正确的是( )
| A.放电时,Mo3S4发生氧化反应 |
| B.放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- |
| C.充电时,Mg2+向阴极迁移 |
| D.充电时,阳极反应式:xMg2++2xe-→xMg |