下列图示与对应的叙述相符的是
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
| C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大 |
下列说法正确的是( )
| A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
反应A(g)+ B(g)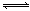 C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
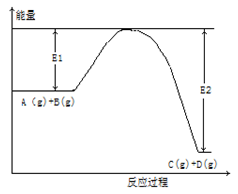
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
一定温度下,某气体反应达到化学平衡,平衡常数K=c(A)•c2(B)/ c2(E) •c(F),恒容时,若温度适当降低,则F的浓度增加,下列说法中正确的是
A.降低温度,正反应速率减小、逆反应速率增大
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s) A(g)+2B(g)
A(g)+2B(g)
D.该反应的焓变△H>0
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )

A.2SO2(g)+O2(g) 2SO3(g);△H<0 2SO3(g);△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
C.H2(g)+I2(g) 2HI(g);△H>0 2HI(g);△H>0 |
D.N2(g) +3H2(g) 2NH3(g);△H<0 2NH3(g);△H<0 |
在相同温度和压强下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质 物质的量 实验 |
CO2 |
H2 |
CO |
H2O |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
2a mol |
a mol |
0 mol |
0 mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n (CO)的大小顺序是
A.丁>乙>丙=甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
某温度时,在密闭容器中发生反应:aX(g)+bY(s) 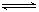 cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
| A.平衡正移 | B.(a+b)<(c+d) | C.Z的体积分数变小 | D.X的转化率变大 |
在恒温恒容的密闭容器中,反应A(g)+B(s) 2C(g)达到化学平衡状态的是
2C(g)达到化学平衡状态的是
| A.消耗1molA的同时消耗1mol B |
| B.消耗n molA,同时生成2nmolC |
| C.气体的总体积不变 |
| D.容器内气体密度不变 |
下列事实不能用勒夏特列原理解释的是
| A.光照新制的氯水时,溶液的pH逐渐减小 |
B.高温高压有利于N2和H2转化为NH3(N2(g)+3H2(g) 2NH3(g);△H<0) 2NH3(g);△H<0) |
| C.打开汽水瓶时,有大量气泡逸出 |
| D.氨水应密闭保存于低温处 |
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
| T/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列有关叙述正确的是
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
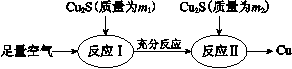
反应Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =" -768.2" kJ·mol-1
反应II:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH =" +116.0" kJ·mol-1
①在反应Ⅱ中,每生成1 mol SO2转移电子________mol。
②反应Cu2S(s)+O2(g) =2Cu(s)+SO2(g)的ΔH =________ kJ·mol-1。
③ 理论上m1:m2=________。
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。
①制硫酸中重要的一步反应是
2SO2(g)+O2(g) 2SO3(g) ΔH =" -196" kJ·mol-1。
2SO3(g) ΔH =" -196" kJ·mol-1。
右图表示将2.0 mol SO 2 和1.0 mol O 2 置于1 L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。
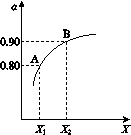
X代表的物理量是________。A对应条件下平衡常数K=________。
② 下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因________。
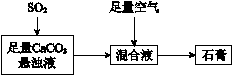
(3)工业硫酸中往往含有一定量SO 2 ,测定过程如下:取m g工业硫酸配成100 mL溶液,取出20.00 mL溶液,加入1 mL指示剂,用c mol·L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是________。
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
测得不同时间的NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/×10-3mol·L-1 |
1.00 |
0.45 |
0.25 |
0.15 |
0.10 |
0.10 |
| c(CO)/×10-3mol·L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是 A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90% D.使用催化剂可以提高单位时间CO和NO的处理量
D.使用催化剂可以提高单位时间CO和NO的处理量