向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
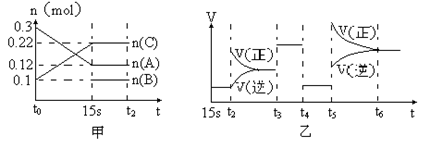
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
反应3H2(g) + N2(g) 2NH3(g) ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
2NH3(g) ΔH = -46.19 kJ. mol-1,关于这个反应的平衡常数K,下列说法正确的是( )
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |
下列说法不正确的是
| A.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大 |
| B.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| C.属于放热和熵增加的反应,就更易自发进行 |
| D.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小 |
化学反应原理在生产和科研中有重要的应用,请利用相关知识回答下列问题。
I.常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)  5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:

(1)该反应的平衡常数表达式K=__________;
(2)0~0.5min内的平均反应速率v(CO)=_________;
(3)下列叙述能说明反应达到平衡的是( )
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率,反应物不再转化为生成物
D.混合气体的平均相对分子质量不再改变
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是( )
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2 倍
D.平衡时混合气体的密度不变
II.一定条件下在密闭容器中加入NH4I发生反应:A.NH4I(s) NH3(g)+HI(g),
NH3(g)+HI(g),
B.2HI(g)  H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
III.己知:2NO2 N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
向甲、乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。相同条件下发生如下反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是( )
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法错误的是( )

A.x可能等于2也可能等于3
B.若向平衡后的乙容器充入C,则再次达到平衡时A的体积分数减小
C.若升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同
D.若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol/L<c(A)<0.5mol/L
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g)  2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )

| |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
| X |
1 |
0.80 |
0.66 |
0.58 |
0.52 |
0.50 |
0.50 |
| Y |
2 |
1.80 |
1.66 |
… |
… |
… |
… |
A.前5min用Z表示的平均反应速率为0.2mol/(L·min)
B.该反应的正反应是放热反应,且T1>T
C.在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变
D.若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7%
在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热。欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A.升高温度 | B.适当增大压强 | C.加入催化剂 | D.从容器中分离出氨 |
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
| t/min |
2 |
4 |
6 |
8 |
10 |
| n(A)/mol |
0.16 |
0.13 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率ν(C) ="0.02" mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
下列事实不能用勒沙特列原理解释的有( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l);
K(g)+NaCl(l);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A.2个 | B.3个 | C.4个 | D.5个 |
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN﹣⇌[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe( SCN)]2+与温度T的关系如图,则下列说法正确的是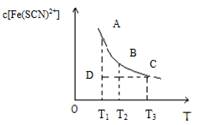
| A.FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN﹣⇌ [Fe( SCN)]2+△H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.T2温度下,向B点溶液中加入FeCl3固体,平衡状态会从 B点变到A点 |
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)  MnO(s) + CO2(g) ②2MnO(s) + O2(g)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
| A.平衡常数减小 | B.MnCO3质量不变 | C.CO2压强不变 | D.MnCO3物质的量增加 |
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
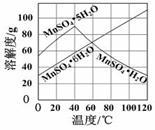
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O ="=" 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
向2L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s) N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0. 70 |
_______ |
| T2 |
_______ |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2)/c(NO)不变