葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):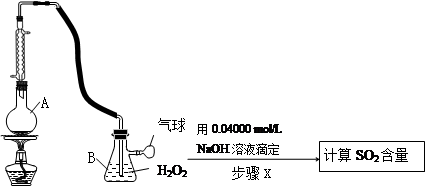
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
某同学以反应2Fe3++2I- 2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
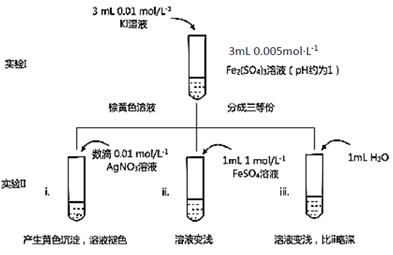
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
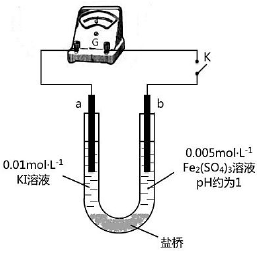
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol·L-1 AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②该实验与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 、 、 (填字母)。

(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g)  NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
A.υ(NH3)= 2υ(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数 (填“增加”、“减小”或“不变”)。
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2O NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)。
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积。
| 物理量 实验序号 |
V(溶液)/mL |
NH4Cl /g |
温度/℃ |
pH |
… |
| 1 |
100 |
m |
T1 |
|
… |
| 2 |
100 |
m |
T2 |
|
… |
| 3 |
100 |
2m |
T2 |
|
… |
请分析,实验1、2的目的是探究 对溶液中NH4Cl水解程度的影响,实验2、3的目的是探究 对溶液中NH4Cl水解程度的影响。
(8分)某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。
已知:2NO2(g) N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为__________________。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如右图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。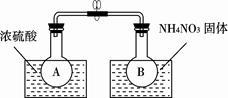
请回答:
①A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向_____________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将_____________(选填“增大”“减小”或“不变”)。
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K= 。(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时v (正)_____________ v (逆)(填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。

(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2 b.2CO2 + 6H2
C6H12O6+6O2 b.2CO2 + 6H2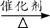 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4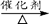 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2  CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应b中理论上原子利用率为 。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
用下图装置进行 转化为
转化为 的转化率测定实验:
的转化率测定实验: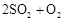

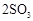
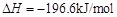 。已知:
。已知:
| |
熔点(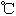 ) ) |
沸点(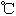 ) ) |
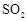 |
-72.4 |
-10 |
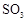 |
16.8 |
44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。
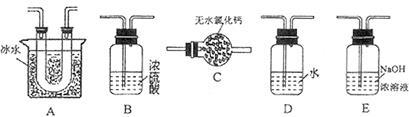
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸有顺利滴入烧瓶中,甲装置所起作用的原理是 。
(4)开始实验时,先从乙处均匀通入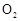 ,为使
,为使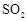 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中“当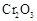 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有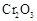 处的反应管时,
处的反应管时,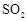 的转化率会 (填“升高”、“降低”或“不变”)。
的转化率会 (填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的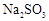 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入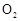 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中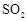 的转化率为 %(保留小数点后一位)。
的转化率为 %(保留小数点后一位)。
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
|
|
|
|
120 |
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
6.50×10-3 |
4.00×10-3 |
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是 ;
③由此实验得出的结论是 。
(2)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是 ;在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同),NO2的转化率将 。
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂 的比表面积m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4. 00×10-3 |
80 |
| Ⅱ |
① |
② |
③ |
④ |
120 |
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
⑤ |
⑥ |
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下: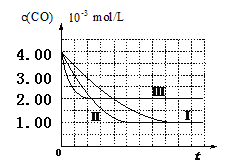
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”);
为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5 mL 0.1 mol·L-1的KI溶液于试管,滴加0.1 mol·L-1的FeCl3溶液5~6滴,振荡;
探究活动二:在上述试管中加入2 mL CCl4,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0.1 mol·L-1的KSCN溶液5~6滴,振荡。
(1)写出探究活动一中反应的离子方程式________ ___________。
(2)探究活动二的实验现象为________________
A.溶液分层,上层呈紫色
B.溶液分层,下层呈紫色
C.溶液分层,均为无色
(3)在探究活动三中,可以证明该化学反应有一定的限度的实验现象是
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究
反应中
和
的相互转化。实验如下:
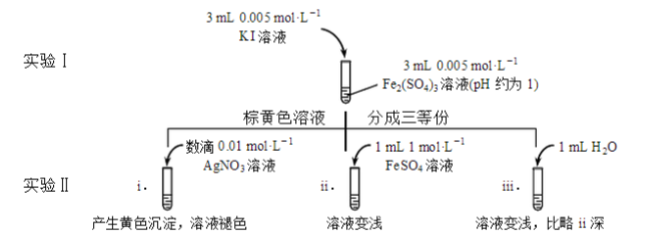
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到。
(2)iii是ii的对比试验,目的是排除有ii中造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,
向
转化。用化学平衡移动原理解释原因:。
(4)根据氧化还原反应的规律,该同学推测i中
向
转化的原因:外加
使
降低,导致
的还原性弱于
,用下图装置(a、b均为石墨电极)进行实验验证。
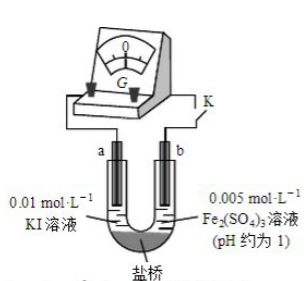
①
闭合时,指针向右偏转,b作极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01
溶液,产生的现象证实了其推测,该现象是。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中
向
转化的原因,
①转化原因是。
②与(4)实验对比,不同的操作是。
(6)实验I中,还原性:
>
;而实验II中,还原性:
>
,将(3)和(4)、(5)作对比,得出的结论是
。
为证明化学反应有一定的限度,进行如下探究活动: I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+) Ⅱ.继续加入2ml CCl4振荡. Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为 ;
探究活动Ⅱ的实验现象为 。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 |
现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] |
若产生① , 则② 不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 |
若③ , 则④ 成立; |
ⅱ.写出实验操作“步骤一”中反应的离子方程式为 。
实验题:(共15分)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ; ② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
酯是重要的有机合成中间体,请回答下列问题:
(1)实验室制取乙酸乙酯的化学方程式为:_____________________。
(2)欲提高乙酸的转化率,可采取的措施有__________________________________、
_____________________________________________等。
(3)若用下图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:___________、
__________________。
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因: 。
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题。现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.7 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
(说明:选择性100%表示反应生成的产物是乙酸乙酯和水)
①根据表中数据,下列________(填编号),为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能是_________________。