在容积可变的密闭容器中,2mo1N2和8mo1H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
| A.5% | B.10% | C.15% | D.20% |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:则下列描述正确的是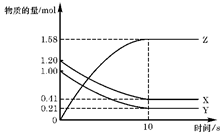
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.应开始时10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s,正反应速率与逆反应相等 |
D.反应的化学方程式为:X(g)+Y(g)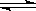 Z(g) Z(g) |
(10分)、在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1molX和3molY,此时容积为VL。保持恒温恒压,发生反应X(g)+ 3Y(g) 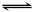 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4molZ,则反应达到平衡时,平衡气体中Y的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2molX和6molY反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105Pa,若a : b =" 1" : 3,则a=
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
下列有关说法正确的是
| A.该反应的正反应是气体体积减小的吸热反应 |
| B.K1<K2(K为该条件下反应的平衡常数) |
| C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 |
| D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压 |
某恒温恒容的容器中,建立如下平衡:2A(g)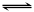 B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
| A.都增大 | B.都减小 |
| C.前者增大后者减小 | D.前者减少后者增大 |
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)  Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数为0.263。
Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数为0.263。
若在1100℃时,测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下该反应是否处于平衡状态 (填“是”或“否”),此时化学反应速率是V正 V逆(填“>”、“<”或“=”),其原因是 。
某温度下,将2 mol A和3 mol B充入一密闭的容器中发生反应:aA(g)+B(g)
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为( )
| A.40% | B.60% | C.24% | D.4% |
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/ mol·L-1 |
0.010 |
0.020 |
0.020 |
| c(CO2) / mol·L-1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
在一定条件下,某密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g) 2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
| A.4mol SO2和2mol O2 | B.5mol SO2和3mol O2 |
| C.4mol SO2和4mol O2 | D.4mol SO2、2mol O2和2mol SO3 |
已知反应:N2(g)+3H2(g) 2NH3(g)△H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是( )
2NH3(g)△H<0,向某体积恒定的密闭容器中按体积比1﹕3充入N2和 H2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化示意图,Y可以是( )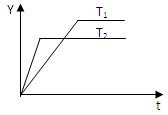
| A.N2的转化率 | B.混合气体的密度 |
| C.H2的体积百分含量 | D.密闭容器内的压强 |
下列平衡体系在体积不变时加入所给物质,平衡移动的是( )
A.FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 |
B.N2(g)+3H2(g)  2NH3(g),加入HCl 2NH3(g),加入HCl |
C.CaCO3(s)  CaO(s)+CO2(g),加入CaCO3 CaO(s)+CO2(g),加入CaCO3 |
D.2SO2(g)+O2(g)  2SO3(g),加入N2 2SO3(g),加入N2 |
一定条件下,对于可逆反应:X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
| A.c1∶c2=1∶3 | B.平衡时Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率之比为1:3 | D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1 |
800℃时,某反应达到平衡,平衡常数K=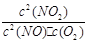 。恒容时,温度降低,NO浓度减小。下列说法正确的是( )
。恒容时,温度降低,NO浓度减小。下列说法正确的是( )
| A.该反应是焓变为负值 |
| B.恒温恒容下,通入Ar气以增大压强,则平衡右移 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为2NO2(g)  2NO(g)+O2(g) 2NO(g)+O2(g) |
可逆反应2SO2+O2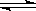 2SO3在密闭容器中达到了平衡,下列说法正确的是
2SO3在密闭容器中达到了平衡,下列说法正确的是
| A.SO2和O2不再化合,反应停止了 |
| B.容器内压强保持不变 |
| C.SO2、O2和SO3的浓度相等 |
| D.SO2、O2和SO3的物质的量之比为2:1:2 |
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
(1)该反应的平衡常数表达式为K= __ _____________ 。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;
结论二:__________________________________________________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:_______________________________________________。