(Ⅰ)有可逆反应A(g) + 3B(g)  2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示: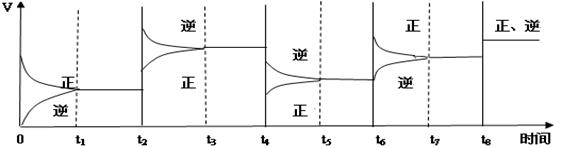
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为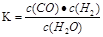
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
E. 消耗n mol H2的同时消耗n mol CO
如图所示,隔板I固定不动,活塞II可自由移动。M、N两个容器中均发生如下反应:A(g)+3B(g) 2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是
2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是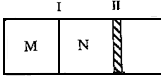
A.起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同
B.起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大
C.起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短
D.起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器N中气体的密度较大
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2 2SO3,状态Ⅱ时达平衡,则O2的转化率为( )
2SO3,状态Ⅱ时达平衡,则O2的转化率为( )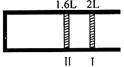
| A.40% | B.60% | C.80% | D.90% |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
将2 mol A和1 mol B充入一个密闭容器中,在一定条件下发生:2A(g)+B(g) xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为
xC(g)达到平衡,测得C的物质的量分数为c%;若开始充入容器中的是0.6 mol A,0.3 mol B和1.4 mol C,达平衡时C的物质的量分数仍为c%,则x的值可能为
| A.2 | B.3 | C.4 | D.5 |
对于反应2NO2(g)  N2O4(g),在一定条件下达到平衡,在温度不变时,欲使的比值增大,应采取的措施是( )
N2O4(g),在一定条件下达到平衡,在温度不变时,欲使的比值增大,应采取的措施是( )
①体积不变,增加NO2的物质的量
②体积不变,增加N2O4的物质的量
③使体积增大到原来的2倍 ④充入N2,保持压强不变
| A.①② | B.②③ |
| C.①④ | D.③④ |
在一恒温恒容密闭容器中,A、B气体可建立如下平衡:
2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:
C(g)+3D(g)现分别从两条途径建立平衡:
I.A、B的起始量均为2mol;
Ⅱ.C、D的起始量分别为2mol和6mol。
下列叙述不正确的是: ( )
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题: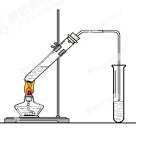
(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
下列说法不正确的是( )
| A.化学反应的速率越大,化学反应的限度越大 |
| B.化学反应中既有物质变化,又有能量变化 |
| C.化学反应的实质是旧键的断裂,新键的形成 |
| D.可逆反应达到化学平衡状态,反应依然在进行 |
往容积为10L的密闭容器内通入40molN2和120molH2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2mol/L。
(1)用H2的浓度变化表示2s内的平均速率为 。
(2) 氮气的转化率是 。
(3) 平衡时混合气体中氨的体积分数是 。
(4) 容器内反应前后压强比是 。
某温度下,C和H2O(气)在密闭容器中发生下列反应:
C(固)+H2O(气) 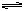 CO(气)+H2(气); CO(气)+H2O(气)
CO(气)+H2(气); CO(气)+H2O(气) 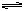 CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为( )
CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为( )
| A.0.1mol/L | B.0.9mol/L | C.1.8mol/L | D.1.9mol/L |
在一定条件下,向2L密闭容器中充入3molX气体和1molY气体,发生下列反应:2X(气)+Y(气)  3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是
3Z(气)+2W(气),在某时刻测定出的下列各生成物的浓度,一定不正确的是
| A.c(Z)=0.45mol/L | B.c(Z)=1.20mol/L |
| C.c(W)=1.00mol/L | D.c(W)=0.80mol/L |
工业生产硫酸时,其中一步反应是2SO2 + O2 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )
| A.增大氧气的浓度可提高反应速率 |
| B.升高温度可提高反应速率 |
| C.使用催化剂能显著增大反应速率 |
| D.达到化学平衡时正逆反应速率相等且都为零 |
右图是可逆反应X+ 3Y 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )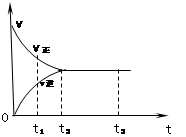
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度 |
| C.t2时,X、Y、Z物质的浓度之比为1:3:2 |
| D.t2- t3,反应不再发生 |