下列叙述正确的是
| A.pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变 |
| B.由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 |
| C.1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 |
| D.某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性 |
下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
| D.常温0.1mol·L-1 HA溶液中C(OH-)/ c(H+)=10-8,则0.01 mol·L-1HA溶液中c(H+)=1×10-4mol·L-1 |
现有室温下四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
10 |
10 |
4 |
4 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液pH = 5,则Va : Vb =" 11" : 9
下列说法正确的是
| A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
B.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
水的电离常数如图两条曲线所示,曲线中的点都符合c(OH一)×c(H+)=常数,下列说法错误的是
| A.图中温度T1>T2 |
| B.图中五点Kw间的关系:B>C>A=D=E |
| C.曲线a、b均代表纯水的电离情况 |
| D.若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性 |
实验测得在常温下0.1mol•L﹣1某一元碱pH≠13,0.1mol•L﹣1的某一元酸H+/OH-= 1012将两种溶液等体积混合后,溶液中离子浓度关系正确的是
| A.[A﹣]>[B+]>[H+]>[OH﹣] | B.[B+]>[A﹣]>[H+]>[OH﹣] |
| C.[B+]>[A﹣]>[OH﹣]=[H+] | D.[A﹣]>[B+]>[OH﹣]>[H+] |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说明不正确的是
A.在冰醋酸中,高氯酸的酸性最强
B.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
C.在冰醋酸中1mol/L的高氯酸的电离度约为0.4%
D.在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42-
如图是一种综合处理SO2废气的工艺流程.若每步反应都完全,下列说法正确的是(设反应过程中溶液的体积不变)
| A.溶液B中发生的反应为:2SO2+O2→2SO3 |
| B.由反应过程可推知氧化性:O2>Fe3+>SO42﹣ |
| C.溶液的pH:A>B>C |
| D.A溶液到C溶液,Fe3+浓度变大 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是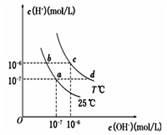
| A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl— |
| B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ |
| D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
常温下,关于pH = 2的盐酸,下列说法不正确的是
| A.溶液中c(H+) = 1.0×10-2 mol·L-1 |
| B.此溶液中由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.加水稀释100倍后,溶液的pH = 4 |
| D.加入等体积pH = 12的氨水,溶液呈中性 |
铝及其化合物用途广泛,研究其性质具有重要意义。
(1)铝离子的结构示意图为 。
(2)美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺,过程如图1所示:

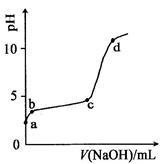
图1 图2
① 铝镓合金与水反应的化学方程式为______________________。
② 该工艺过程中,能量的转化形式分别有_______________(填“什么能转变为什么能”)。
③ 该工艺过程总反应的实质是_____________________。
(3)室温下,往0.2 mol/LAl2 ( SO4)3溶液中逐滴加入1.0 mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图2所示。解释c→d过程中pH增大且幅度较大的原因(请结合必要的化学用语)_____________________。
常温下,两种酸的电离平衡常数如下表:
| 酸 |
电离常数K1 |
电离常数K2 |
| H2SO3 |
1.54×10-2 |
1.02×10-7 |
| H2CO3 |
4.3×10-7 |
5.6×10-11 |
常温下,浓度均为0.1 mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
A.pH:Na2CO3溶液小于Na2SO3溶液
B.结合H+能力:CO32¯弱于SO32¯
C.NaHSO3溶液显酸性的原因是: NaHSO3="==" Na+ + H+ + SO32¯
D.①与②溶液等体积混合后的溶液中:c(SO32-) > c(CO32-) > c(HCO3-) > c(HSO3-)
以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L-1的稀硫酸至少能溶解原料的质量为 。
(2)加入H2O2时反应的离子方程式为 。
(3)已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12。
室温下,若溶液中c(Mg2+)=0.01mol·L-1,欲使溶液中的c(Fe3+)≤1×10-6mol·L-1,需调节溶液pH范围为 。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH在9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L-1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L-1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程) 。
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
②等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:
c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3)
③pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH。(已知酸性:C6H5OH<H2CO3)其溶液 物质的量浓度由小到大顺序为:d、b、c、a
④1L0.1mol/LNH4NO3溶液中氮原子数小于0.2NA
⑤pH=4.5的浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
⑦把0.1mol/L的NaHCO3溶液与0.3mol/LBa(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
⑧在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度不同
| A.①②③⑤ | B.③⑤⑥⑦ | C.①③④⑥ | D.②③⑥⑦ |