已知草酸钙(CaC2O4)在400℃--500℃时发生反应的化学方程式:
CaC2O4="=" CaCO3+CO↑,当温度达到800℃以上,该反应生成的固体开始分解。
(1)若反应控制在400℃--500℃范围内:填写下表
| 参加反应的草酸钙固体的质量分数 |
0 |
60% |
100% |
| 剩余固体中m(O)/m(Ca) |
|
|
|
(2)若取6.4g草酸钙在800℃以上的温度下加热,则
①剩余固体质量的最小值是
②当剩余固体质量为3.9g时,剩余固体中氧元素与钙元素的质量比= (用最简分数表示)
在136
过氧化氢溶液中加入少量的二氧化锰,待完全反应后过滤,得到滤液的质量为3
,同时得到3.2
氧气。
(1)经分析,二氧化锰的质量为
;
(2)计算过氧化氢溶液中溶质的质量分数。
有一包含有碳酸钠和碳酸氢钠的混合物,为了测定其含量,技术员小颖取19g样品放入烧杯中,加入100g水充分溶解后,逐滴滴入稀盐酸并不断搅拌,至B点时恰好完全反应。测出烧杯内溶液的总质量与加入稀盐酸质量的关系曲线如图所示(反应生成的气体全部逸出)。已知碳酸钠与稀盐酸反应分两步进行:
第一步反应:
第二步反应:
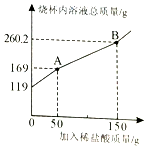
求:(1)图中AB段表示第步反应;反应后生成的二氧化碳质量是g.
(2)所加入的稀盐酸中溶质质量分数是多少?
(3)样品中碳酸氢钠的质量是多少?
菱铁矿(主要成分是
)是炼铁的原料。现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如下图所示。
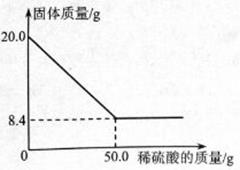
已知:①
②菱铁矿中杂质不参加反应,且难溶于水。
请计算:
(1)20.0g菱铁矿中
的质量为g。
(2)列式计算所用稀硫酸的溶质质量分数(结果准确到0。1%)
现有家庭食用碱样品
(主要成分
,其它成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图.请计算:
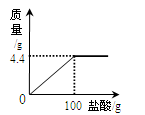
(1)食用碱中碳酸钠的纯度是多少
(2)盐酸的溶质的质量分数是多少 (要求写出计算过程,结果精确到0.1)
一定质量的碳酸钠和氯化钠固体混合物,加入101 克水完全溶解后,再往其中加入100
氯化钙溶液,恰好完全反应。过滤,将滤渣干燥,称得其质量为10
,测得滤液中溶质的质量分数为10
。试计算:
(1)100
氯化钙溶液中溶质的质量。
(2)原固体混合物中碳酸钠的质量分数。
某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
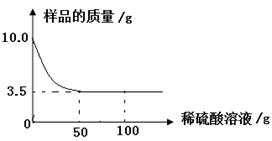
(1)铜锌合金汇中,
的质量分数是.
(2)所用稀硫酸溶液中溶质的质量分数是多少?
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,实验数据如下表:
| |
甲 |
乙 |
丙 |
| 烧杯+稀硫酸 |
200g |
150g |
150g |
| 加入的铁样品 |
9g |
9g |
14g |
| 充分反应后,烧杯+剩余物 |
208.7g |
158.7g |
163.7g |
请你认真分析数据,回答下列问题:
(1)哪位同学所取的稀硫酸与铁样品恰好完全反应;
(2)计算样品中铁的质量分数;
(3)计算恰恰好完全反应后所得溶液中溶质的质量分数。(烧杯的质量为25.4g;计算结果精确到1%)
现有一含杂质的固体氯化钡样品(杂质不溶于水),取12.5g样品放入烧杯中,然后加入39.6g水使其充分溶解,静置后滤去杂质,取10g滤液,加入足量的硝酸银溶液,完全反应后生成沉淀2.87g。试求:(计算结果精确到0.1%)
(1)滤液中溶质的质量分数;
(2)样品中氯化钡的质量分数。
镁是一种活泼性较强的金属,在空气中易发生缓慢氧化,表面呈灰黑色。
(1)镁与氧气的反应属于(填基本反应类型)。要观察金属镁的颜色,需将镁条如何处理。
(2)若30
镁条存放一段时间后,质量变为了34
,则参加反应的氧气为
(假设镁只与氧气反应)。若将上述氧化前和氧化后的镁条分别与足量稀硫酸反应,生成硫酸镁的质量关系是前者后者(填">"、"="或"<")。
(3)将2.4
未氧化的镁加入到97.8
的稀硫酸中,恰好完全反应。求反应后所得溶液的溶质质量分数(假设反应过程中水分未损失)。
有一含有纯碱的食盐样品,为了测定其中碳酸钠的含量,某同学称取30g的样品放入烧杯中,向烧杯中加入100g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为123.4g(假设产生的气体全部逸出。)
(1)反应中生成的气体的质量是 g;
(2)样品中碳酸钠的质量分数是多少?
黄铁矿矿石的主要成分为二硫化亚铁(
),取一块质量为30克的黄铁矿矿石样品在氧气中完全灼烧后得到10克氧化铁(其中的铁全来自二硫化亚铁)同时生成二氧化硫。
(1)二硫化亚铁中硫元素的化合价为
(2)计算黄铁矿矿石样品中二硫化亚铁的质量分数。
学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名"愚人金"),为进一步定量分析黄铜的成分,某同学进行了如下实验:称量黄铜样品
放入锥形瓶中,向其中不断加入稀硫酸,收集生产的气体与所加稀硫酸的质量关系如图所示。求:

(1)黄铜样品中锌的质量
(2)恰好完全反应时,所得溶液中溶质的质量分数。
某补钙剂说明书的部分信息如下图所示。现将有
片该药剂制成的粉末与
盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为
。

(1)青少年缺钙出现的疾病是。
(2)该品牌补钙剂每片含的
质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到
)。
为测定某
合金中铜的质量分数,某同学将10g该合金放入到盛有40g足量稀硫酸的烧杯中,充分反应后,测得烧杯中剩余物的质量为49.9g。
(1)生成氢气的质量为;
(2)计算原合金中铜的质量分数。