食盐因含有氯化镁而易潮解,现有只含氯化镁杂质的食盐10g,将其置于烧杯,加30g水溶解,得40g溶液.再向其中加入未知溶质质量分数的氢氧化钠溶液10g,充分反应后,烧杯内剩余溶液为48.84g。
(1)问生成沉淀的质量;
(2)求反应后溶液中溶质的质量分数.
测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.
(已知
↑杂质不参与反应,也不溶于水)

(1)石灰石样品中碳酸钙的质量是
.
(2)石灰石样品中碳酸钙的质量分数是.
(3)计算稀盐酸溶质的质量分数。
铜仁市地处武陵山区,石灰石资源丰富,某课外小组同学取该样品12.0
于烧杯中,向盛有样品的烧杯中加入足量一定溶质质量分数的稀盐酸溶液充分反应,所用稀盐酸质量(用X表示)和烧杯中剩余固体质量(用Y表示)如图所示(石灰石的主要成分是碳酸钙,杂质不溶于水也不与酸反应),请回答下列问题:

(1)石灰石中碳酸钙的质量是多少?
(2)充分反应后共生成多少二氧化碳?
(3)所用稀盐酸的溶质质量分数是多少?
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:

(1)欲配制溶质质量分数为5%的稀盐酸溶液200
,需要溶质质量分数为37%的浓盐酸多少毫升?(计算结果保留小数点后一位)
(2)化学综合实践活动小组的同学,对一造纸厂排放的污水进行检测,发现其主要的污染物为氢氧化钠.为了测定污水中氢氧化钠的含量,他们量取80
污水于烧杯中,逐滴加入溶质质量分数为5%的稀盐酸至73
时恰好完全反应(污水中的其他成分不与盐酸反应)。求污水中氢氧化钠的质量分数。
200克某硫酸恰好与26克锌完全反应,试计算:
(1)生成氢气的质量;
(2)硫酸溶液中溶质的质量分数;
(3)充分反应后所得溶液的质量.
家里蒸馒头用的纯碱中含有少量的氯化钠,课外探究小组的同学欲测定某超市出售的纯碱样品是否符合标准(标明中碳酸钠的含量为≥96%)。他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应。过滤干燥后,称得沉淀质量为10.0g。请计算:
①纯碱样品中碳酸钠的质量;②该样品是否合格;③反应后所得滤液中溶质的质量分数。
取锌、铜的混合物8
与154.7
稀硫酸恰好完全反应,称得剩余物质的总质量为162.5
。
请计算:
(1)产生氢气的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
某样品由氧化铜和铜组成。取
该样品于烧杯中,向其中加入
某浓度的稀硫酸,恰好完全反应,最终所得溶液质量为
。(已知:
)
(1)所取样品中含铜元素的质量为
.
(2)计算最终所得溶液中溶质的质量分数。(请写出计算过程)
将4g含有可溶性杂质的硫酸铜样品溶于足量水,再向所得溶液中逐滴加入75g一定溶质质量分数的氯化钡溶液(杂质不与氯化钡溶液反应)。实验过程中,生成沉淀的质量与滴入氯化钡溶液的质量关系如图所示。试计算:
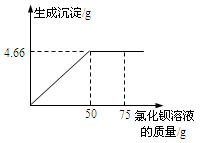
(1)恰好完全反应时,生成沉淀的质量是g。
(2)样品中硫酸铜的质量分数是多少?
(3)反应后的溶液中,氯化钡的质量是多少?
已知烧杯中装有
硫酸和硫酸铜混合溶液,其中含硫酸铜
.向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.

(提示:CuO + H2SO4 = CuSO4 + H2O)请计算:
(1)
.
(2)原混合溶液中
的质量分数.
(3)若取恰好完全反应时所得溶液
配制成
的硫酸铜溶液,需要
的硫酸铜溶液多少克
小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:

①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐 酸,置于电子天平上测出装置总质量。
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。
③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。
| 反应前总质量(克) |
275.58 |
| 反应后总质量(克) |
274.92 |
| 反应前后质量差(克) |
0.66 |
| 容器内气体质量差(克) |
m |
(1)该实验中,对装置中的固态干燥剂的性质有何要求?。
(2)反应前容器内是空气(密度为
),反应后全部是
(密度为
)。则反应前后容器(容积为
)内的气体质量差m为。(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数。( ,钙片中的其它成分不与盐酸反应)
某化学研究小组为了测定一工厂废水中硫酸的溶质质量分数,取100克废水置于烧杯中,加入100克一定质量分数的硝酸钡溶液恰好完全反应(废水中其它成分不与硝酸钡反应)。反应后过滤,将得到的沉淀洗涤、干燥、称重,称得质量为2.33克。(化学反应方程式为:
)请计算:
(1)完全反应后烧杯内剩余的溶液质量为克。
(2)100克废水中硫酸的溶质质量分数是多少?
镁铜合金常用作飞机天线等导电材料,现取某镁铜合金
放入烧杯中,加入足量稀硫酸充分反应后,测得剩余固体的质量为
,请计算:
(1)该镁铜合金中镁的质量;
(2)生成 的质量.
某同学用锌和稀硫酸制取氢气.向气体发生装置中加入一定量锌粒,将30
稀硫酸分三次加入,每次生产气体的质量如下表.
| 次数 |
第一次 |
第二次 |
第三次 |
| 加入稀硫酸质量/ | 10 |
10 |
10 |
| 生成氢气质量/ | 0.04 |
0.04 |
0.02 |
(1)共制得氢气
.
(2)所用稀硫酸的溶质质量分数.
为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数.