(7分)实验室废液桶中收集到大量含有的盐酸与氯化钙的的废液(不考虑其他杂质)。同学们测定该废液中含氯化钙的质量分数,他们取100g废液向其中慢慢滴加质量分数为26.5%的Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成的原因是 。
(2)求废液中含氯化钙的浓度。
7.0g含杂质的铁粉样品与足量稀硫酸反应,产生氢气的物质的量与时间关系如图所示(杂质不与酸发生反应)。计算样品中所含铁的质量分数(根据化学方程式列式计算)。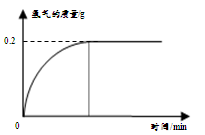
Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: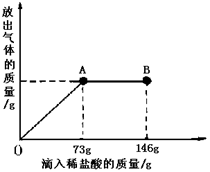
①当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
②当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取26g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为90g,反应后烧杯中物质的总质量为105g。请计算:
(1)反应生成二氧化碳的质量;
(2)样品中碳酸钙的质量分数(结果保留到0.1%)。
某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成
溶液,将其全部加入到
一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是
,将溶液蒸干,得到
硫酸钠。
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%)。
为测定某
溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0 g,滴定过程如图所示。
(滴定反应为:
,
的相对原子质量为108,计算结果均保留1位小数)

(1)
的相对分子质量为:;
(2)计算
溶液的溶质质量分数:;
(3)计算恰好完全反应时,所得溶液的溶质质量分数:。
将Na2CO3和NaCl固体混合物22.3 g放入烧杯中,加入182.1 g稀盐酸恰好完全反应。待没有气泡逸出后,称量烧杯中剩余物质总质量为200 g。请计算:
(1)生成二氧化碳的质量是_ __;
(2)所得溶液中溶质的质量分数是多少?
有CO、CO2和N2的混合气体40 g,其中碳元素的质量分数为30%,使该混合气体与足量灼热的氧化铁完全反应,再将气体通入过量的澄清石灰水中,写出以上过程中发生反应的两个化学方程式:________________________;________________________。充分反应后得到白色沉淀的质量为___________________________。
某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。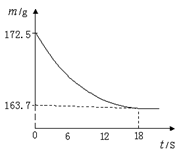
求:(1)计算碳酸钠中各元素的质量比:Na:C:O= 。
(2)碳酸钠的相对分子质量为: 。
(3)生成CO2的质量。
(4)该纯碱样品中Na2CO3的质量分数。
追求化学家的足迹,建立严谨的科学实验基础。
(1)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两类:
a.加热分解硝酸钾、氧化汞、硝酸银等
b.用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)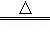 2MnSO4+2X+O2↑
2MnSO4+2X+O2↑
①a中反应物均可制得氧气,因为它们组成的共同点: ;
②b中物质X化学式为 ;
(2)舍勒由于受“燃素说”的影响(即认为一切可以燃烧的物质都是由灰和“燃素”组成的,物质燃烧后剩下的是灰,而燃素本身变成了光和热,逸散到空中去了),导致“氧气”从他的鼻尖下溜走.化学家拉瓦锡结合大量实验事实,否定了“燃素说”认为的“物质燃烧后质量应当减轻”的观点,真正发现了氧气
①写出铁丝在氧气中燃烧的化学方程式: ;
②以铁燃烧的事实,指出上述“燃素说”的谬误: .
(3)拉瓦锡还通过定量研究分析实验,推进了俄国化学家洛蒙诺索夫的发现获得公认并成为化学的重要定律:即在化学变化中物质的质量是守恒的。也称物质不灭定律。它是自然界普遍存在的基本定律之一。
①由质量守恒定律可知,化学反应前后一定不变的是_______(填字母)。
a原子种类
b原子数目
c分子种类
d分子数目
e元素种类
f物质种类
②X、Y、Z三种物质各15g ,在一定条件下充分反应生成新物质M 30g ;若增加10g X,X与Z恰好完全反应。则参加反应的Y、Z的质量比为_______。
某兴趣小组需要配制100g质量分数为9.8%的稀硫酸,假设常温下该稀硫酸的PH值为0.在装有100g该稀硫酸的烧杯中加入104.4gNa2CO3溶液,恰好完全反应,溶液呈中性.
(1)硫酸(H2SO4)的相对分子质量为 ;
(2)硫酸(H2SO4)中氧原子、氢原子的原子个数比为 ;
(3)实验室只有98%的浓硫酸,密度为1.84g/cm3.需要量取 mL(保留一位小数)
(4)如果向烧杯中滴加的碳酸钠溶液质量约为150g,在下图中,画出烧杯内溶液的PH值变化图象(标出Na2CO3溶液的质量)




(5)计算所得溶液的溶质质量分数是多少?(写出计算过程)
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线。
已知硫酸钾,氯化钾的水溶液都呈中性,根据下图所示的信息计算:
(1)加入的稀硫酸溶液的质量为 克。
(2)反应后所得溶液的溶质质量分数。
(3)拓展:若用等质量等质量分数的盐酸代替稀硫酸,充分反应后测定溶液的酸碱度,你认为pH 7(填>或=或<),理由是 。
过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验。测得相关数据如下图所示:
(1)剩余的混合物中二氧化锰的质量为__________g
(2)反应生成氧气的质量为 g
(3)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程)
某化学兴趣小组的同学采集了一些大理石样品,为测定该样品中碳酸钙的质量分数,取样品6g粉碎成粉末状置于烧杯中,向其中加入10%的稀盐酸并不断搅拌,恰好不再有气泡产生时(已知杂质不与稀盐酸反应),共用去稀盐酸36.5g。
(1)计算样品中碳酸钙的质量分数。
(2)计算反应后所得溶液中溶质的质量分数?(结果保留到0.1%)