2015年初中毕业升学考试(广西桂林卷)化学
6月5日为"世界环境日",今年我国的主题是"践行绿色生活"。下列做法符合这一主题的是()
| A. | 倡导使用节能灯 | B. | 使用一次性筷子 |
| C. | 随意排放生活污水 | D. | 随便丢弃废电池 |
的原子结构示意图为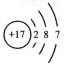 ,下列关于
的说法错误的是()
,下列关于
的说法错误的是()
| A. | 电子层数是3 | B. | 核内质子数是17 |
| C. | 最外层电子数是7 | D. | 在化学反应中易失电子 |
要配制100g5%的蔗糖溶液,以下操作会导致所配溶液的浓度偏低的是()
| A. | 称取5g含杂质的蔗糖 | B. | 用量筒量取90mL水 |
| C. | 搅拌后玻璃棒上有液体残留 | D. | 量筒中的水未完全倒入烧杯中 |
关于反应 的说法,错误的是
| A. | 二氧化锰做该反应的催化剂 |
| B. | 二氧化锰的质量随着反应减少 |
| C. | 二氧化锰加快氯酸钾的分解速率 |
| D. | 二氧化锰的化学性质没有改变 |
下列所用试剂能达到实验目的的是
| 实验目的 |
试剂 |
|
| A |
鉴别浓硫酸与稀硫酸 |
木条 |
| B |
鉴别氯化钡溶液与氯化钙溶液 |
碳酸钾溶液 |
| C |
除去氮气中的氧气 |
水 |
| D |
除去二氧化碳中的一氧化碳 |
氢氧化钠溶液 |
下列关于复分解反应的说法正确的是()
| A. | 中和反应不属于复分解反应 | B. | 反应物必需都溶于水 |
| C. | 反应物一定是酸 | D. | 生成物一定有盐 |
三种酸分别与足量的金属镁充分反应,生成等质量的氢气,反应消耗 的分子数目之比为3:6:2。下列关于 的推断合理的是( 、 、 分别表示三种酸
现有①金刚石、②氯化钠、③酒精、④生石灰、⑤小苏打、⑥一氧化碳,从中选择恰当的物质序号。
(1)用于治疗胃酸过多;
(2)用于配制生理盐水;
(3)用作食品干燥剂;
(4)用于刻画玻璃;
(5)用于冶炼金属;
(6)用作内燃机的燃料。
人类的生产和生活都离不开金属。
(1)生铁和钢中最主要的元素是;用铝壶烧水主要利用铝具有良好的性。
(2)铝制品有良好的抗腐蚀性,其原因是在空气中铝的表面易形成致密的。
(3)验证
、
、
的金属活动性顺序,可选择的试剂是(填字母序号)。
| A. |
、
、
溶液
|
B. | 、 、 溶液 |
| C. | 、 、 溶液 | D. | 、 、 、稀硫酸 |
A在B中充分燃烧生成C和D,A、B、C、D的微观示意图如下所示。

看图回答:
(1)属于氧化物的是(填字母序号)。
(2)A中氮、氢原子数之比为,氮、氢元素质量比为。
(3)A在B中充分燃烧的化学方程式为,基本反应类型为。
水是宝贵的自然资源。
(1)下列常用净水方法,可以降低水的硬度的是
A.过滤 B.吸附 C.蒸馏
(2)下图表示氯化钠、硝酸钾、硫酸镁三种物质的溶解度曲线。请回答:
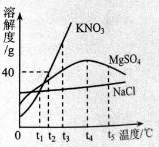
①
时,饱和溶液的溶质质量分数相同的两种物质是
②
时,将40g硝酸钾放入60g水中,充分溶解后,所得溶液的质量为
③
时,溶解度最大的是
④
时,其它条件不变,把硫酸镁饱和溶液升温到
,观察到的现象是
⑤氯化钠溶液中含有少量硝酸钾杂质,提纯的方法是
淀粉是一种白色不溶于水的粉末。淀粉在人体内经酶的催化作用,与水发生一系列反应,最终产物是葡萄糖。葡萄糖在酶的催化下缓慢氧化生产二氧化碳和水,并放出能量。
(1)淀粉的组成元素是氧、、 。
(2)列举淀粉的两个物理性质:、。
(3)写出葡萄糖在人体内缓慢氧化的化学方程式:。
甲、乙、丙、丁都是初中化学中最常见的物质,已知它们由
、
、
、
、
、
6种元素中的2种或3种组成,丙与甲、乙、丁都能发生反应。将这四种物质的溶液按下图所示相互滴加,现象为:①产生白色沉淀;②有气泡冒出;③无明显现象。
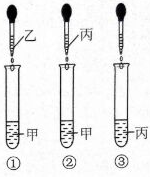
(1)甲、乙、丙、丁都属于
(2)试管②中产生的气体是
(3)试管①中反应的化学方程式是
(4)向试管③滴加的溶液溶质可能是
根据下列实验示意图,回答问题。
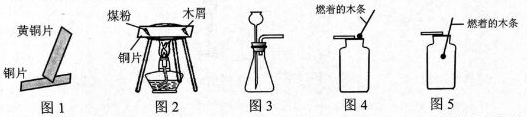
(1)图1铜片与黄铜片相互刻画,铜片表面留下明显划痕,说明铜片比黄铜片的硬度(填"大"或"小")。
(2)图2煤粉和木屑最先燃烧的是,燃烧的顺序说明燃烧的条件之一是。
(3)在实验室中用图3装置制取二氧化碳,反应的化学方程式是。
(4)图4、图5为两种验满二氧化碳的方法,其中正确的操作是图(填数字序号)。
在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
| 实验序号 |
滴加
溶液的量 |
实验现象 |
| ① |
第1~6滴 |
产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
| ② |
第7~9滴 |
产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式 。
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究。
【查阅资料】
I.氢氧化铜在室温下温度,70℃-80℃时可脱水分解生成氧化铜
II.铜酸钠[
]溶于水,溶液呈亮蓝色。
【猜想与讨论】
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解。其他同学一致否定了他的猜测,理由是。
同学们交流讨论后,提出以下两种猜想。
猜想一:少许氢氧化铜可溶于足量水中。
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色。
【实验探究】
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验。请你填写表中的空格。
| 实验序号 |
实验方法与操作 |
实验现象 |
结论 |
| ③ |
将少许
粉末加到5mL蒸馏水中,充分振荡 |
猜想一错误 |
|
| ④ |
猜想二正确 |
【结论与反思】
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成
,反应的化学方程式是。
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是。






 粤公网安备 44130202000953号
粤公网安备 44130202000953号