(16+2分)目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验2条件下的H2O 体积分数为;
②下列方法中可以证明上述已达平衡状态的是;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 |
lgK |
||
| 700K |
900K |
1200K |
|
| C(s)+H2O(g)=CO(g)+H2(g) |
-2.64 |
-0.39 |
1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) |
-1.67 |
-0.03 |
1.44 |
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g)△ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g)△ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,
下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与极(填“C”或“D”)相连。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下: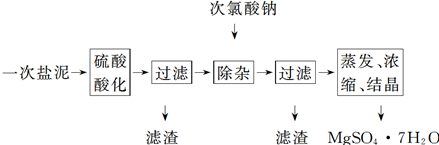
(1)用硫酸调整溶液pH为1~2,硫酸的作用是________________________________________。
(2)加次氯酸钠溶液至pH为5~6并加热煮沸约5~10 min,滤渣中主要含MnO2和另两种沉淀:__________________、____________(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为___________________________
(3)若除杂后过滤,发现滤液发黄,需采取的措施是________
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是________________________________________
(5)晶体中结晶水含量的测定:准确称取0.20 g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚中,置于马沸炉中,在200 ℃脱水1 h。为准确确定脱水后的质量,还需要经过的操作有冷却(干燥器中)至室温→___________________________
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50 g,用200 mL水溶解,加入2 mol·L-1 HCl溶液5 mL,将溶液加热至沸腾,在不断搅拌下逐滴加入5~6 mL 0.5 mol/L BaCl2溶液,充分沉淀后,得沉淀0.466 g,则样品中w(SO42-)=________________。
(7)已知:Na2CO3·10H2O (s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
下列叙述中正确的有
①燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护
| A.3 | B.4 | C.5 | D.6 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤ |
B.HS-电离的离子方程式:HS-+H2O H3O++S2- H3O++S2- |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小 |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为: |
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
下列叙述不正确的是:
| A.用反应热数据的大小判断不同反应反应速率的快慢 |
| B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.用平衡常数的大小判断化学反应可能进行的程度 |
下列有关说法正确的是
| A.向醋酸钠溶液中加水稀释时,溶液中所有离子浓度都减小 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
对下列图像描述正确的是
| A.图①可表示氨气通入乙酸溶液至过量过程中溶液导电性的变化 |
B.根据图②可判断可逆反应A2(g)+3B2(g) 2AB3(g)的ΔH<0 2AB3(g)的ΔH<0 |
| C.图③表示等体积、等pH的盐酸与醋酸溶液加入等量水稀释时的pH变化 |
D.图④可表示压强对可逆反应A(g)+B(g) 2C(g)+D(g)的影响,乙的压强大 2C(g)+D(g)的影响,乙的压强大 |
关于下列各图的叙述正确的是
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列说法不正确的是()
A.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡正向移动 NH3·H2O+H+达到平衡后,升高温度平衡正向移动 |
| B.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,该现象不足以说明Ksp(BaSO4)与Ksp(BaCO3)大小关系。 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |

通常情况下,前者无法决定后者的是
| A.原子的核外电子排布----元素的金属性强弱 |
| B.化合物的内在结构----电解质的相对强弱 |
| C.反应温度的高低----化学平衡的移动程度 |
| D.反应物的化学性质----化学反应速率的快慢 |
下面涉及的是工业生产硝酸铵的过程。
(1)写出NO2和水反应的化学方程式,并标出电子转移的方向和数目。。
(2)已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H= +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:,
氨催化氧化生成NO反应的化学平衡常数表达式K=。
(3)已知:N2(g)+3H2(g)  2NH3(g)△H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g)△H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
| A.升高温度 | B.使用催化剂 |
| C.及时移出氨 | D.循环利用和不断补充氮气 |
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为。
(5)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池。
例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2 + O2 →2CH3CHO可设计成燃料电池:
正极为:O2+4H++4e-=2H2O负极为:
电池工作时,负极附近溶液的pH(填“升高”、“降低”或“不变”)。
关于下列各图的叙述,正确的是



甲乙丙丁
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的烧热为483.6kJ·mol-1 |
| B.乙表示Cu形成金属晶体时的堆积方式 |
| C.丙装置中烧杯a中的溶液pH降低 |
| D.丁装置中待镀铁制品应与电源正极相连 |
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 =+571.2 kJ·mol-1①
4CO(g) + BaS(s)△H1 =+571.2 kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=+226.2 kJ·mol-1②
2CO2(g) + BaS(s)△H2=+226.2 kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是。
下列说法正确的是
| A.任何化学反应不一定都有反应热 |
| B.使用催化剂可以改变反应的平衡常数 |
| C.升高温度使反应加快,是因为降低了反应的活化能 |
| D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物, C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答:
(1)写出化合物J的电子式:_______________。
(2)G3+比G2+的稳定性的原因,组成D、H、K三种元素的第一电离能由大到小的顺序为(写元素符号)。A分子中心原子的杂化方式为,A可与Cu2+形成天蓝色的物质,画出该离子的结构示意图,写出一种与化合物I 为等电子体关系的阴离子
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为 _________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316 J的能量,写出此反应的热化学方程式:_________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的电极反应为:___________。
②若用此电池电解300mL 5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________