[上海]2014届上海市普陀区高三上学期质量调研化学试卷
关于汽油、甘油和花生油的叙述正确的是
| A.都属于油脂 | B.都无固定的沸点 |
| C.都能浮在水面上 | D.只有花生油能与氢氧化钠溶液反应 |
按照有机物的命名规则,下列命名正确的是
| A.CH2Br-CH2Br二溴乙烷 |
| B.CH3OOCCH3甲酸乙酯 |
C. 硬脂酸甘油脂 硬脂酸甘油脂 |
D. 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
关于碘及其化合物的说法正确的是
| A.“碘遇淀粉变蓝色”,“碘”指碘元素 |
| B.为了补碘,要多食用含高碘酸的食物 |
| C.I- 与IO3- 可以大量共存于溶液中 |
| D.通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
铝的某种超原子结构(Al13)具有40个价电子时最稳定。请预测稳定的Al13所带的电荷数为
| A.-1 | B.+2 | C.0 | D.+3 |
通常情况下,前者无法决定后者的是
| A.原子的核外电子排布----元素的金属性强弱 |
| B.化合物的内在结构----电解质的相对强弱 |
| C.反应温度的高低----化学平衡的移动程度 |
| D.反应物的化学性质----化学反应速率的快慢 |
短周期元素W、X、Y、Z的原子序数依次增大,它们的简单离子中都能破坏水的电离的组合是
| A.Y3+、W- | B.Z2-、X+ | C.X+、Y3+ | D.X+、Z2- |
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
| 选项 |
目的 |
实验方法 |
| A |
除去Na2CO3固体中的NaHCO3 |
置于坩埚中加热至恒重 |
| B |
除去NaCl中少量KNO3 |
将混合物制成热饱和溶液,冷却结晶,过滤 |
| C |
除去CO2中的HCl气体 |
通过NaHCO3(aq,饱和),然后干燥 |
| D |
除去C2H5Br中的Br2 |
加入足量Na2SO3(aq),充分振荡,分液 |
将足量CO2分别通入下列各溶液中,所含离子仍能大量共存的是
| A.K+、AlO2-、 Cl-、 NO3- | B.Na+、CH3COO-、C6H5O-、HCO3- |
| C.Na+、ClO-、SO42-、Cl- | D.NH4+、 Al3+、SO42-、H+ |
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g) + O2(g) 2SO3(g) + 197 kJ实验测得有关数据如下:
2SO3(g) + 197 kJ实验测得有关数据如下:
| 容器编号 |
起始时各物质的物质的量 / mol |
达到平衡时体系能量的变化/KJ |
||
| SO2 |
O2 |
SO3 |
||
| 甲 |
2 |
1 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
放出热量:Q2 |
下列判断中不正确的是
A.197>Q1>Q2
B.达到平衡时SO2的体积分数:甲>乙
C.两容器中反应的平衡常数相等
D.生成1molSO3(l)时放出的热量大于98.5kJ
对于同温同压条件下的气体12C18O与14N2,判断正确的是
| A.体积相等时密度相等 | B.原子数相等时中子数相等 |
| C.体积相等时电子数相等 | D.质量相等时质子数相等 |
把200mL NH4HCO3和Na2CO3 的混合溶液分成两等份,取一份加入含amol NaOH的溶液恰好反应完全;取另一份加入含bmol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为
| A.(l0b - 5a))mol/L | B.(2b-a)mol/L |
C.( )mol/L )mol/L |
D.(5b- )mol/L )mol/L |
药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得: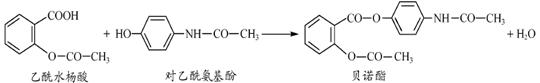
有关上述反应物和产物的叙述不正确的是
| A.上述三种有机物中共有四种含氧官能团 |
| B.贝诺酯分子中有9种不同化学环境的氢原子 |
| C.贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol |
| D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚 |
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 |
NH4+、 Na+、 Mg2+ |
| 阴离子 |
OH-、 NO3-、 SO42- |
若取等质量的甲、乙、丙配制成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),则乙物质
A.可能是NaOH B.可能是NH4NO3
C.不可能有SO42- D.一定不是(NH4)2SO4
运用电离常数判断可以发生的反应是
| 酸 |
电离常数(25oC) |
| 碳酸 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 |
Ki=2.4×10-9 |
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO
已知2Al+2NaOH+2H2O→2NaAlO2+3H2。对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.6 mol H2,被还原的水分子数目为1.2NA |
| B.有2.7 g Al参加反应时,转移的电子数目为0.3NA |
| C.有6.72 L H2生成时,反应中转移的电子数目为0.6NA |
| D.溶液中每增加0.1mol AlO2-,Na+的数目就增加0.1NA |
给定条件下,加点物质能完全消耗于化学反应中的是
| A.用50mL 12mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气 |
| B.向100mL 3 mol/L的硝酸中加入5.6g铁粉 |
| C.常温下,将1g铝片投入20mL 18.4 mol/L的硫酸中 |
| D.在5×107Pa、500℃和铁触媒条件下,1mol氮气和6mol氢气反应 |
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分
含量与时间的关系如图-2所示。下列分析正确的是 
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g) 2Z(g) |
| B.0~3 min内,v(X)=0.2 mol•L-1•min-1 |
| C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 |
| D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强 |
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实
验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得
溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为
| A.2.20 | B.2.33 | C.2.00 | D.0.50 |
硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等。
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取的。高温下制取纯硅有如下反应(方法1):
①SiO2(s)+2C(s) Si(s)+2CO(g)
Si(s)+2CO(g)
②Si(s)+2Cl2(g) SiCl4(g)
SiCl4(g)
③SiCl4(g)+2H2(g) →Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有 种不同能级的电子,最外层的p电子有 种自旋方向。
(2)硅与碳同主族,单质的还原性:碳 硅(填写“同于”、“强于”或“弱于”)。反应①之所以能进行的原因是 。
(3)反应②生成的化合物的电子式为 ;该分子为 分子(填写“极性”或“非极性”)。
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L。则:a b(填写“大于”、“等于”或“小于”)。
(5)在t秒内,反应②中v(SiCl4)= (用含a、b的代数式表示)。
(6)工业上还可以通过如下反应制取纯硅(方法2):
④Si(粗) +3HCl(g) SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)
⑤SiHCl3(g)+H2(g) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有: (选填2条)。
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3•3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
有机物A、B、C、D、E、F、G的相互关系如下图所示。
(1)检验A中卤元素的实验方法是 。
(2)B的结构简式为 ;①的化学反应类型是 。
(3)G在实验室中可通过两步反应氧化成F。其中第一步反应的条件是 ,反应得到的产物可能有(填写结构简式) 。
(4)F是一种二元酸,它在一定条件下可与G反应生成高分子化合物,该高分子的结构简式为 。
写出反应④的化学反应方程式 。
已知:R-CHO
 ,
,
R-CN RCOOH 。
RCOOH 。
氯吡格雷(clopidogrel)是一种用于抑制血小板聚集的药物。以A(C7H5OCl)为原料合成氯吡
格雷的路线如下:
完成下列填空:
(1)C中含氧官能团的名称为 ,C→D的反应类型是 。
(2)Y的结构简式为 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有 种。
(3)C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环。该反应的化学方程式为 。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为 。
(5)写出A(芳香族化合物)的所有同分异构体的结构简式 。
(6)已知:
写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:CH3CH2OH CH2=CH2
CH2=CH2
金属元素及其化合物在科学研究和生产生活中有着广泛的用途。
(1)现有一种铜粉与氧化铜粉末的混合物。经测定,该混合物中铜元素与氧元素的质量之比为5:1。该混合物中铜与氧化铜的物质的量之比为 。
(2)取铝合金(含铝90%)1.5 g与80 mL 3mol•L-1 盐酸充分反应(合金中其它成分不参加反应)。滤去不溶物,将滤液稀释到100mL,取出稀释液5mL,加入0.6 mol•L-1 的氨水使Al3+ 恰好完全沉淀。
上述铝合金和盐酸反应的过程中生成氢气_________L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水_________mL。
(3)将1.84g金属钠投入98.16 g水中,向反应后的溶液里通入一定量的CO2(g),将溶液小心蒸干。计算可得固体质量的最大值。
(4)向a mL 0.8mol•L-1 NaOH(aq) 中通入b mol CO2(g),反应所得混合液的成份随b的物质的量的不同而不同。请通过计算完成下表:(溶质的质量用含a、b的代数式表示)
| b的取值范围(mol) |
溶质的成份 |
溶质的质量(g) |
| b<4a×10- 4 |
|
|
| |
Na2CO3、NaHCO3 |
|




 粤公网安备 44130202000953号
粤公网安备 44130202000953号