[湖北]2013-2014学年湖北省三校高二上学期期末联考化学试卷
全球变暖给我们敲响了警钟,地球正面临巨大的挑战。下列说法不正确的是
| A.推广“低碳经济”,减少温室气体的排放 |
| B.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
| C.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
| D.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展 |
下列说法不正确的是
| A.炔烃的官能团为-C≡C- | B.乙烯的结构简式为CH2CH2 |
| C.在铁制品上镀铜时用金属铜作阳极 | D.用Na2S做沉淀剂除去废水中的Cu2+和Hg2+ |
美国宇航局马里诺娃博士找到了一种比CO2有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化”火星,使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.全氟丙烷的电子式为: |
| B.相同压强下,沸点:C3F8<C3H8 |
| C.全氟丙烷分子中既有极性键又有非极性键 |
| D.分子中三个碳原子处于同一直线上 |
下列各组物质不属于同分异构体的是
| A.间二甲苯和乙苯 | B.2-甲基-2,4-己二烯和3,4-二甲基-1-戊炔 |
| C.2,2,3-三甲基戊烷和3-乙基己烷 | D.2-甲基丙烯酸和甲酸正丙酯 |
为除去下列物质所含的杂质(括号内的物质),有关除杂试剂和操作合理的是
| A.乙醇(水):加氢氧化钙固体,过滤 |
| B.乙酸乙酯(乙酸):加氢氧化钠溶液,分液 |
| C.溴水(溴化钠):除杂过程中涉及的操作有:加CCl4,萃取、分液 |
| D.苯甲酸(苯甲酸钠):加稀硫酸,蒸馏 |
组成为C10H14的芳香烃,其苯环上有两个取代基时的同分异构体数目为
| A.6种 | B.9种 | C.12种 | D.15种 |
下列叙述中正确的有
①燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护
| A.3 | B.4 | C.5 | D.6 |
实验:①1 mol·L–1AgNO3溶液和0.1 mol·L–1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c; ②向滤液b中滴加0.1 mol·L–1KI溶液,出现浑浊; ③向沉淀c中滴加0.1 mol·L–1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+ (aq)+Cl–(aq) Ag+ (aq)+Cl–(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
NOx是汽车尾气中的主要污染物之一。通过NOx传感器可监测NOx的含量,其工作原理示意图如下。下列说法正确的是
| A.Pt电极作负极,NiO电极作正极 |
| B.Pt电极上发生的是氧化反应 |
| C.NiO电极上发生的是还原反应 |
| D.NiO电极的电极反应式为NO+O2–-2e–=NO2 |
下列解释事实的反应方程式正确的是
A.氨水使酚酞溶液变红:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| B.向FeCl3溶液中加入Mg(OH)2,溶液中有红褐色沉淀生成:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.铅蓄电池放电时的正极反应为:PbO2+2e–+4H+=Pb2++2H2O |
| D.钢铁的析氢腐蚀与吸氧腐蚀的负极电极反应相同:Fe-3e–=Fe3+ |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
常温下,在c(H+)/c(OH−)=1×1012的溶液中,下列各组离子能大量共存的是
| A.Fe2+、Mg2+、NO3−、SO42− | B.Fe3+、Na+、Cl−、SCN− |
| C.NH4+、Al3+、NO3−、Cl− | D.Ca2+、K+、Cl−、HCO3− |
下列实验操作导致所读出数值比真实值小的是(假设其他操作均正确)
| A.对滴定管仰视读数:18.80 mL |
| B.用蒸馏水润湿pH试纸测定某浓度的硫酸溶液的pH=5 |
| C.用量筒量取饱和食盐水时,俯视读数:8.8 mL |
| D.中和热测定时,用铜棒代替环形玻璃搅拌棒搅拌,测定反应的最高温度:38.8℃ |
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
| A.②④ | B.② | C.①② | D.③④ |
中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可以利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
常温下,用0.1000mol/LNaOH溶液分别滴定25.00mL0.1000mol/L盐酸溶液和
25.00mL0.1000mol/LCH3COOH溶液,滴定过程中pH变化曲线如下图所示。下列判断不正确的是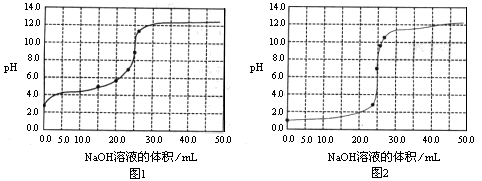
| A.滴定盐酸的pH变化曲线为图2 |
| B.在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–) |
| C.滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–) |
| D.当c(Na+)=c(CH3COO–)+ c(CH3COOH)时,溶液的pH<7 |
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 |
c(CO)/mol·L–1 |
c(O2)/mol·L–1 |
c(CO2)/mol·L–1 |
υ(正)和υ(逆) 大小比较 |
| ① |
2.0×10–4 |
4.0×10–4 |
4.0×10–4 |
υ(正)=υ(逆) |
| ② |
1.0×10–3 |
4.0×10–4 |
5.0×10–4 |
υ(正) υ(逆) |
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4·5H2O。工艺流程如下
(部分操作和条件略):
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加H2O2溶液,稍加热。
III.向II的溶液中加入CuO粉末至pH=4。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1。
V.蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得晶体。
已知部分阳离子生成氢氧化物的pH、Ksp(25℃)如下表:
| 物质 |
Fe(OH)3 |
Fe (OH)2 |
Cu(OH)2 |
| 开始沉淀时pH |
2.7 |
7.6 |
4.7 |
| 完全沉淀时pH |
3.7 |
9.6 |
6.7 |
| Ksp |
4.0×10–38 |
8.0×10–16 |
2.2×10–20 |
(1)II中发生反应的离子方程式是 。
(2)II中将Fe2+氧化为Fe3+的目的是 。
(3)用K3[Fe(CN)6](铁氰化钾)验证II中Fe2+是否转化完全的现象是 。
(4)III中发生反应的离子方程式是 。
通过计算说明在此条件下的溶液中Fe3+是否沉淀完全________________________(提示:当溶液中某离子浓度小于1.0×10–5 mol/L时可认为该离子沉淀完全)。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因 。
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
| ①H2SO4溶液中的HSO4– |
②NaHSO4溶液中的HSO4– |
③CH3COOH |
④HCl溶液 |
| 10% |
29% |
1.33% |
100% |
(1)写出H2SO4在水中的电离方程式 。
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:CuFeS2 + 4H+=Cu2+ + Fe2+ + 2H2S↑ 2Fe3+ + H2S=2Fe2+ + S↓+ 2H+ ,阳极区硫酸铁的主要作用是 。(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。写出析出红色固体的反应方程式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯( )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| |
熔点 ℃ |
沸点 ℃ |
水溶性 |
| 甲醇 |
—97.8 |
64.7 |
易溶 |
| 苯甲酸(一元弱酸) |
122.4 |
249.3 |
常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 |
—12.3 |
198 |
难溶 |
合成苯甲酸甲酯的流程如下:
请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。



A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应
 粤公网安备 44130202000953号
粤公网安备 44130202000953号