(16+2分)目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平: ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验2条件下的H2O 体积分数为 ;
②下列方法中可以证明上述已达平衡状态的是 ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 |
lgK |
||
| 700K |
900K |
1200K |
|
| C(s)+H2O(g)=CO(g)+H2(g) |
-2.64 |
-0.39 |
1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) |
-1.67 |
-0.03 |
1.44 |
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,
下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题: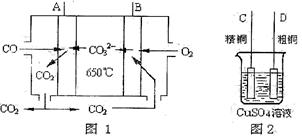
①写出A极发生的电极反应式 ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号