(1)在Cu +2H2SO4(浓)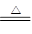 CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
氧化剂 ;还原剂 氧化产物 ;还原产物
(2)在 2H2S +O2=2S+2H2O 反应中,请用单线桥法标出电子转移情况,并指出被氧化的元素是 ;被还原的元素是 。(写元素符号)
(1)在Cu +2H2SO4(浓)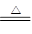 CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
CuSO4 +SO2↑+2H2O反应中,请用双线桥法标出电子得失情况,并指出氧化剂、还原剂,氧化产物、还原产物。
氧化剂 ;还原剂 氧化产物 ;还原产物
(2)在 2H2S +O2=2S+2H2O 反应中,请用单线桥法标出电子转移情况,并指出被氧化的元素是 ;被还原的元素是 。(写元素符号)