对大量的实验事实进行分析,找出一些规律,并根据这些规律和物质的内在联系,对一些物质性质进行推测,这是化学学习中非常重要的科学方法。请你仿照下表中的思维过程,以学过的酸、碱、盐的化学性质为例,填写下表中的空格(所填规律不能重复)。
| 实验事实(每空举两例) |
规 律 |
推测同类物质所具有的相同性质 |
| 示例:盐酸、稀硝酸能使紫色石蕊试液变红 |
酸溶液能使紫色石蕊试液变红 |
稀硫酸也能使紫色石蕊试液变红 |
| Ⅰ.碳酸钙、碳酸钠都能与稀盐酸反应,生成二氧化碳气体 |
(2) |
(3) |
| Ⅱ. (4) |
(5) |
(6) |
在Cu(NO3)2、AgNO3和KNO3的混合溶液中加入一定量镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。
(1)请说出滤出的固体中一定含有哪些成分?滤液中一定含有哪些成分?
(2)写出反应过程中一定发生的化学反应方程式:
如图是某趣味实验装置图,挤压胶头滴管后,可观察到什么现象?请分析其原因,并写出化学方程式。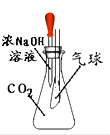
某同学将8g纯碱溶解在42g水中,配制了一瓶溶液,储放时忘记制作标签。
(1)请你为该瓶溶液制作一张标签。(填入右图中)
(2)如何用简单实验证明该溶液呈碱性,简述实验步骤和主要实验现象。
请回答下列有关金属的问题。
(1)铁在潮湿的空气中容易生锈。小明同学发现生锈后的铁钉质量会增加,于是得出“质量守恒定律”也有例外,你认为该同学的推测正确吗?请加以解释。
(2)某化学兴趣小组为测定Al、Fe、Cu、Ag四种金属的活动性,设计了如下方法:
先将粗细相同的铝丝和铁丝分别放入稀盐酸溶液中,然后将铜丝放入硝酸银溶液中。试回答下面问题:
实验发现,短时间内铝丝表面无气泡产生,几分钟后产生大量气泡。产生该现象的原因可能是什么?
小明同学分析认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和他一起设计实验方案并进行实验,达到探究目的。
以下是初中化学的一些基本实验:
(1)A中可燃物应取过量的原因是______________________;
B中试管①收集到的气体是 ;
D中硬质玻璃管内发生反应的化学方程式为 ;
(2)请将上述不能达到实验目的的装置加以改正 。
我省安阳市发掘一座东汉大墓,经考古学家确认为曹操高陵,内有金、银、铜、铁等多种金属质地的器物。请根据所学知识回答以下问题:
(1)曹操墓中有大量的青铜器,而早在宋朝初期,人们发现江西上饶有一苦泉,蒸发这种苦泉水会得到胆矾(CuSO4·5H2O),熬苦泉水的铁锅用久了会成铜锅,这也是湿法炼铜的起源。写出这个反应的化学方程式 ;这个反应类型属于 反应。久置的铜制品表面会锈蚀生成铜绿[Cu2(OH)2CO3],铜绿是铜与空气中的氧气、水和 共同作用的结果。
(2)曹操墓中的铁器已锈迹斑斑,金属铝是近一百年才被冶炼使用的,铝的活动性比铁强,但铝却在空气中表现出良好的抗腐蚀性能,其原因是 。
(3)现代生产和生活中,大量使用的不是纯金属,而是它们的合金。合金和纯金属比较,其优越的性能有 (答出一条即可)
(4)(3分)为探究铁、铜、银的活动性顺序,某同学设计了一组实验:①铁片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③银片浸入稀硫酸中。 这组实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到目的(写出实验步骤现象和化学方程式)。
(5)(3分)用2000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
进行如下组合实验时,当打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。请按要求回答相关问题:
A B C D E F
(1)A中发生反应的化学方程式为 。
(2)B中白磷能够燃烧的原因是 。
(3)D中发生反应的化学方程式为 。
(4)E中的实验现象是 。
(5)用F装置收集气体的依据是 。
水煤气的主要成分是CO和H2(还含有少量CO2和水蒸气),某同学通过下列实验,验证水煤气的主要成分,请根据下图所示装置,回答有关问题。(友情提示:无水硫酸铜遇水会变蓝,可用于水蒸汽的检验。)
(1)A装置中反应的化学方程式是____________ _______;
(2)B装置内盛放的物质是_________,其作用是___________________________________;
(3)C装置内盛放的物质是_______________;
(4)D装置内的现象是______________________________________________________;
(5)若E装置与F装置位置颠倒,其后果是__________________________________________。
(4分)于老师为学生做了一个化学魔术实验“水中生火”,将装有氧气的试管,管口向下扣向烧杯底部,忽然底部管口处燃烧起火,实验如图所示,请回答下列问题:
(1)猜想水中藏有的物质是__________________
(2)用理化知识解释“水中生火”的原因_______________________________________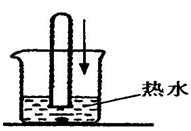
(3)此实验说明物质燃烧的条件是—_______________________________________
同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究。
上述两种物质发生反应的化学方程式为 ,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
[实验探究]
㈠确定废液中是否含有盐酸
⑴选择试剂:根据盐酸的化学性质,同学们选用了如下图所示的五种物质,物质x是酸碱指示剂中的 溶液。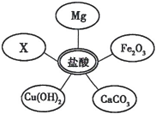
⑵实验验证:某同学向废液中加入少量的镁粉,观察到 ,确定废液中一定没有盐酸。
㈡确定废液中是否含有Na2CO3
某同学选用 测出废液的pH=l0,确定废液中一定含有Na2CO3。
你还可以选择 或 ,确定废液中一定含有Na2CO3。
㈢处理废液,回收利用
欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
| 方案 |
加入试剂 |
分离方法 |
方案评价 |
| 1 |
适量Ca(NO3)2溶液 |
过滤、蒸发结晶 |
不可行,理由是 |
| 2 |
过量的 |
蒸发结晶 |
可行 |
溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾由的油污,可用洗涤剂洗去,是因为洗涤剂能_______________(填“溶解”或“乳化”)油污。
(2)打开汽水瓶盖会有大量气泡冒出。这种现象说明气体的溶解度与_________有关。
(3)某固体物质的溶解度曲线如下图所示:

20ºC时,要使该物质的溶液由饱和溶液变为不饱和的,通常可采用的方法有
某工厂实验室的废水中含有大量的硝酸银和硝酸铜,某同学想从上述的废液中回收金属银,并得到副产品固体。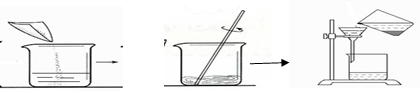
⑴ 请指出上述实验操作中的错误
⑵ 写出发生反应的化学方程式
某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下: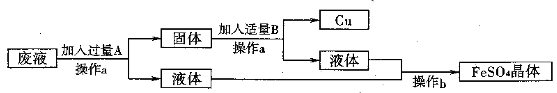
(1)操作a、b的名称分别是________、_______。
(2)写出流程中有关反应的化学方程式:___________________________、_______________。
以上两个反应能够发生的原因是___________________________。