向一定量的澄清石灰水中通入适量的二氧化碳,使氢氧化钙全部转化为碳酸钙沉淀,得到的沉淀质量为1.00g。计算澄清石灰水中氢氧化钙的质量(计算结果精确至0.01g)。
为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸,恰好完全反应,测得剩余固体的质量为2g。(杂质不溶于水也不与酸反应)
请完成下列分析及计算:
(1)10g样品中杂质的质量为 g。
(2)计算稀盐酸中溶质的质量分数。
我国著名的化学家侯德榜发明了联合制碱法,大大提高了原料的利用率,其反应原理之一为NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,某化工厂消耗117t氯化钠,理论上可生产碳酸氢钠的质量是多少?
(注:在20℃时,将二氧化碳通入含NH3的饱和NaCl溶液中能生成 NaHCO3晶体和NH4Cl溶液)
农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算讨程)。
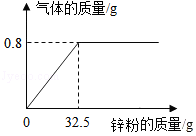
向一定量的稀硫酸中加入锌粉(仅含不溶于酸的杂质),所加锌粉的质量与产生气体的质量的关系如图所示。求:
(1)此过程中产生氢气的最大质量是 克。
(2)锌粉中锌的质量分数为多少。(请写出计算过程)
小华同学发现自家的水壶用久以后底部会附着一层白色固体,查阅资料后得知,水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢),于是他邀请同学小雪进行了以下实验探究。
探究一:自家的井水是软水还是硬水?
取少量井水样品于试管中,加入 ,振荡,出现大量浮渣,由此得出结论:自家的井水属于 。
探究二:白色固体的主要成分是什么?
[假设与猜想]猜想Ⅰ:CaCO3。
猜想Ⅱ: (填化学式)。
猜想Ⅲ:CaCO3和Mg(OH)2。
[实验与探究]取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,白色固体溶解,有 产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪认为小华的结论不严谨,理由是 。经过两人反复讨论,进一步设计了如下实验。
实验步骤 |
实验现象 |
实验结论 |
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
无明显现象 |
猜想Ⅰ成立 |
|
猜想Ⅲ成立 |
[拓展与迁移]取含有MgCl2和HCl的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是 克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
镁在国产大飞机C﹣919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图象如图),过滤,称量滤液质量为147g,求:
(1)图象中m= g。
(2)滤液中溶质的质量分数是多少?

向盛有10g纯碱样品(含有少量氯化钠)的烧杯中加入稀盐酸。加入80g稀盐酸时,恰好完全反应。反应后烧杯内物质总质量为86.7g。
(1)该反应生成二氧化碳的质量为 g;
(2)求该纯碱样品中碳酸钠质量分数(写出计算过程)。
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O

请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
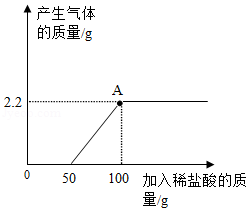
向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是 g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是 。
(3)计算所加稀盐酸中溶质的质量分数。(写出规范的计算过程)。
某兴趣小组发现某块土地玉米长势不好,为探究其原因,开启了项目学习之旅。
[查阅资料]玉米适宜在pH为6.0~7.0的土壤中生长;植物生长需要多种营养元素,包括碳、氢、氧、氮、磷、钾、钙、镁等大量元素和其他微量元素。
[任务一]检测土壤的酸碱度并制定改良方案
(1)检测该地土壤的酸碱度
可选用的实验用品:精密pH试纸(可精确到0.1)、标准比色卡、pH计、其他自选
实验步骤 |
测量结果 |
实验结论 |
步骤一:将3份不同位置的土样,干燥后分别与自来水按2:5的质量比在不同的烧杯中混合,充分搅拌后静置; |
试样一:pH=4.2 试样二:pH=4.4 试样三:pH=4.5 |
该土壤pH<6.0,不适合玉米生长 |
步骤二: 。 |
反思与评价:该实验方法有一处不够严密,请指出并说明原因 。
(2)探究熟石灰对土样酸碱性的改变情况
实验方法:取300g土样和 g蒸馏水混合,向其中加入一定量熟石灰,充分搅拌后静置,用pH计测定清液的pH;
测量结果:清液的pH为12.1;
反思:若要使改良的土壤适合玉米生长,需控制加入熟石灰的量。
(3)熟石灰用量的测定
实验目的:研究使300g土样呈中性所需的熟石灰的质量
实验方法: 。
(4)查阅资料,常用的酸性土壤改良剂有:生石灰、熟石灰、草木灰(主要成分K2CO3)、含钙的贝壳灰 (主要成分CaCO3) ; 要使改良后土壤的pH约为7,也可加入稍过量的 (从上述改良剂中选择)。
[任务二]分析土壤肥力
通过观察,该土地上玉米叶色略有发黄,且有倒伏现象;该小组同学建议施加适量含氮元素和钾元素的复合肥,如 。
市售的某些银首饰是银、锌合金。小庆同学取该合金样品20g,加入100g稀硫酸恰好完全反应,产生气体质量与反应时间的关系如图所示,计算:
(1)该合金中锌的质量(精确到0.1g)。
(2)该稀硫酸中溶质的质量分数(精确到0.1%)。

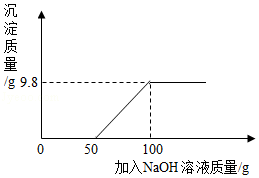
某学校化学实验室有一杯含盐酸和氯化铜的废液,该校化学兴趣小组的同学取109.8g废液于烧杯中,向其中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示:
试计算:
(1)产生沉淀的总质量是 克;
(2)109.8g废液中氯化铜的质量是 克。
(3)计算加入100g氢氧化钠溶液并充分反应后烧杯内所得溶液中溶质的质量分数。
国家明令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙是一种安全无毒物质,常带有结晶水,广泛用于果蔬保鲜、空气净化、污水处理等方面。某化学兴趣小组为测定某过氧化钙样品(CaO2•xH2O)中的结晶水,称取4.86g过氧化钙样品,灼热时发生如下反应:
2[CaO2•xH2O] 2CaO+O2↑+2xH2O
完全反应冷却后称量,得到剩余固体的质量为3.36g。
(1)反应中生成O2的质量是 g。
(2)计算样品CaO2•xH2O中的x值(写出详细的计算过程)。