如图所示,是小科建构的铜及其化合物之间相互转化的关系图。
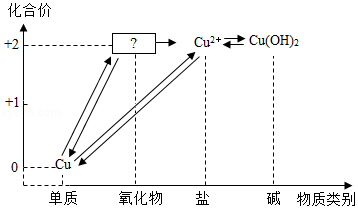
(1)写出图中“?”处物质的化学式 。
(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是 。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操
作步骤及所需要的试剂 。
某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如表:
次数 |
1 |
2 |
3 |
4 |
5 |
加入盐酸溶液质量/g |
12.5 |
12.5 |
12.5 |
12.5 |
12.5 |
剩余固体质量/g |
8.5 |
7.8 |
a |
6.4 |
6.4 |
请分析计算:
(1)表中a的值是 。
(2)9.2g固体中铁的质量是 。
(3)稀盐酸的溶质质量分数是多少?
(4)与硫酸铜反应的铁的质量是多少?
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的 装置(填字母)。
(2)小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见表。合理选择表中数据并计算碱面中碳酸钠的质量分数;
实验次数 |
碱面样品质量/克 |
稀盐酸质量/克 |
二氧化碳质量/克 |
1 |
11.0 |
50.0 |
1.1 |
2 |
11.0 |
200.0 |
4.4 |
3 |
11.0 |
250.0 |
4.4 |
(3)按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。
"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1 克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为 。
(2)这包白色粉末的成分为 。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
阅读下列材料,回答问题:
材料一:研究人员发现大气层中特别是南极上空的臭氧层日益变薄。进入大气平流层的氯氟烃(一类合成有机化合物,应用于冰箱和空调的制冷剂、灭火器等)是造成臭氧层变薄的主要原因。因为在紫外线的照射下,平流层中的臭氧存在如下平衡:O 3 O 2+O;而氯氟烃进入平流层后会分解产生氯原子(Cl),进而发生下列反应:Cl+O 3→ClO+O 2;ClO+O→Cl+O 2
研究表明:平流层中1个氯原子大约可以破坏1×10 5个臭氧分子。氯氟烃分解产生的氯原子在上述反应中起着 作用。
为测定某石灰石样品中碳酸钙的质量分数,取25g该样品(杂质不参加反应也不溶于水),加入盛有146g稀盐酸的烧杯中,恰好完全反应,气体全部逸出,反应后烧杯内物质的总质量为162.2g。计算:
(1)生成二氧化碳的质量;
(2)石灰石样品中碳酸钙的质量分数;
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。
为测定某CuSO 4溶液中溶质的质量分数,取150g CuSO 4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见表。请计算:
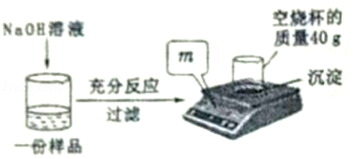
| |
实验1 |
实验2 |
实验3 |
| 样品质量/g |
50 |
50 |
50 |
| NaOH溶液质量/g |
20 |
40 |
60 |
| m/g |
44.9 |
49.8 |
49.8 |
(1)50g CuSO 4溶液完全反应时,所得沉淀的质量为 g。
(2)CuSO 4溶液中溶质的质量分数。
取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。

硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7:16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0g与足量的氧气缓慢通入一定量水中(NO x+O 2+H 2O→HNO 3),得到60.0g硝酸溶液溶液的溶质质量分数为多少?(写出计算过程)
某兴趣小组取CaCO 3和CaCl 2的固体混合物7.5g,加入到盛有一定质量某浓度稀盐酸的烧杯中,恰好完全反应,气体全部逸出后,所得不饱和溶液的质量为41.8g。
烧杯及烧杯内物质质量随反应时间变化如表。
| 反应时间 |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯及烧杯内物质质量 |
64 |
62.9 |
61.8 |
61.8 |
计算:
(1)生成CO 2的质量为 g。
(2)烧杯中原有稀盐酸的溶质质量分数是多少?
化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
[探究一]溶解过程中的能量变化
如图所示,同学们设计了不同的实验方案进行探究:

(1)实验一中的硝酸铵溶解后,溶液温度 (填"升高"、"降低"或"不变")。
(2)实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此小明得出"氢氧化钠溶于水时放出热量"的结论,你是否同意小明的结论并写出你的理由 。
[探究二]氢氧化钠的化学性质
如图所示,同学们用氢氧化钠溶液进行了下列实验,请分析并回答下列问题:

(1)A试管中观察到的现象是 。
(2)B试管中发生反应的化学方程式: 。
(3)C、D试管中均无明显现象。
①为了证明D中已发生化学反应,向该试管中再加入足量的 ,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)

整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。请写出步骤Ⅱ中所加试剂 。
[探究三]氢氧化钠的应用
(1)实验室中的应用
实验室中能用氢氧化钠溶液吸收的气体是 (填字母)。
a.二氧化碳
b.水蒸气
c.氯化氢
d.氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的 不同。
(2)工业中的应用
氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9t(H 2SO 4的质量分数为20%),可以处理的废水质量是 t。
结合化学方程式中的数据分析:若将等质量、等溶质质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,请判断溶液中一定含有的溶质,并简述你的判断理由: 。
某化学小组初步探究氢氧化钠的性质、变化和获得方法。
查阅相关资料:
Ⅰ.部分酸、碱和盐的溶解性表(室温)
| 阴离子/阳离子 |
OH ﹣ |
NO 3 ﹣ |
Cl ﹣ |
SO 4 2 ﹣ |
CO 3 2 ﹣ |
| H + |
|
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
| K + |
★溶 |
溶 |
溶 |
溶 |
溶 |
| Na + |
溶 |
溶 |
溶 |
溶 |
溶 |
| Ca 2+ |
微 |
溶 |
溶 |
微 |
不 |
| Cu 2+ |
不 |
溶 |
溶 |
溶 |
﹣﹣ |
说明:"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,"﹣"表示那种物质不存在或遇到水就分解了。
Ⅱ.氢氧化钠的工业制法:电解氯化钠饱和溶液
2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑
[性质与变化]
(1)上表★处"溶"对应的物质是 。
(2)完成下列物质转化,各写出一个符合要求的化学方程式。
①  。
。
②  。
。
[实践与应用]工业上常用电解氯化钠饱和溶液的方法生产氢氧化钠
(3)某化工厂计划生产16t氢氧化钠,请计算:
①氢氧化钠的相对分子质量是 。
②理论上需要氯化钠的质量是 t。
(4)工业生产中可制得含NaOH溶质质量分数约为45%的液碱产品,经进一步处理还可以制得固体氢氧化钠产品。请根据已有知识,对"进一步处理"中使用的方法提出设想并简要说明理由。
(5)工业固体氢氧化钠质量指标如图所示,请对产品中的杂质来源作出合理分析。
| 工业固体氢氧化钠质量指标 (合格品) 氢氧化钠(NaOH)/%≥98.0 碳酸钠(Na 2CO 3)/%≤1.0 氯化钠(NaCl)/%≤0.08 |
碳酸钠: 。
氯化钠: 。