向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,c点溶液中的溶质是 。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是多少?(结果精确到0.1%)

(1)探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积。
出现这种现象的可能原因是 ;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2②CuCl2+Fe═FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等。
①固体沉积物质量与加入铁粉质量相等的原因是 ;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是 ,反应②消耗铁粉的质量是 (计算结果精确到0.1)。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
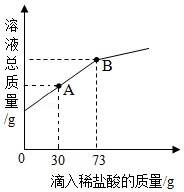
22的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).
今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气.先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数 |
第一次 |
第二次 |
第三次 |
加入稀硫酸质量/g |
20 |
20 |
20 |
生成氢气的质量/g |
0.08 |
0.08 |
0.04 |
试计算:
(1)共制得氢气 g.
(2)实验所用稀硫酸中溶质的质量分数.(写出计算过程)
醋的主要成分是醋酸,其化学式为CH3COOH,醋不仅是调味品,而且还有较强的灭菌、抑毒的作用。

小明为判断家中的米醋含酸量是否合格,取100mL米醋(见标签)于锥形瓶中,然后再向锥形瓶中逐渐加入一定溶质质量分数的碳酸氢钠溶液,反应过程中,当加入碳酸氢钠溶液的质量至以下数值时,对充分反应后锥形瓶中剩余物质的质量进行了记录,测得的部分数据如下,请根据有关信息回答问题(提示:化学方程式为:CH3COOH+NaHCO3═CH3COONa+H2O+CO2↑)
加入碳酸氢钠溶液质量(g) |
25 |
50 |
100 |
155 |
175 |
锥形瓶内剩余物质质量(g) |
123.9 |
147.8 |
195.6 |
248.4 |
m |
(1)醋酸中碳、氢、氧三种元素的质量比为 。
(2)100mL米醋与足量碳酸氢钠溶液反应产生的二氧化碳质量为 g,表中m的数值为 。
(3)请通过计算判断该产品含酸量是否合格?(写出计算过程)
硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。工业上用废铁屑和含硫酸的废液来制取硫酸亚铁,变废为宝。现用5.6t铁屑与100t废液恰好完全反应(已知铁屑只和废液中的硫酸反应),请你计算:
(1)可生成硫酸亚铁的质量;
(2)所用废液中硫酸的溶质质量分数。
小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 |
第1次 |
第2次 |
第3次 |
第4次 |
剩余固体质量(g) |
10.8 |
9.6 |
8.1 |
8.1 |
试计算:
(1)完全反应后生成二氧化碳的质量是 g.
(2)求珍珠粉中碳酸钙的质量分数.
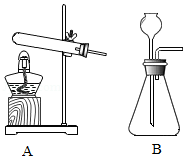
实验室制取气体常用的发生装置如图所示,回答下列问题。
(1)小刚选择A装置作为制取氧气的发生装置,反应的化学方程式为 ,小明选择B装置也能作为制取氧气的发生装置,其理由是 。与A装置相比,B装置具有的优点是 。
(2)某实验小组的同学们在进行“二氧化碳的实验室制取和性质”的实验活动时,选取上述装置制取二氧化碳气体后,产生了许多废液。于是他们在课外兴趣小组活动时对废液的成分进行了如下探究:
[提出问题]废液的主要成分是什么?
[猜想与假设]小红的猜想:废液中只有CaCl2;小丽的猜想:废液中还有HCl。
[查阅资料]CaCl2溶液呈中性。
[设计与实验]①小红做了一组对比实验:取等质量的废液和CaCl2溶液分别于两支试管中,各滴加2滴酚酞溶液后,发现溶液都不变色,认为自己的猜想是正确的。大家经过讨论,认为小红的猜想不正确,理由是 。
②针对小丽的猜想,同学们进行了如下实验探究:
实验方案 |
一 |
二 |
三 |
实验操作 |
|
|
|
预期的现象 |
与标准比色卡对比pH<7 |
|
白色沉淀 |
实验结论 |
废液中含有HCl |
废液中含有HCl |
废液中含有HCl,反应的化学方程式为 。 |
③小牛对上述探究活动思考后,认为利用酸的化学性质还可以设计不同方案探究小丽的猜想:
操作步骤 |
预期的现象 |
实验结论 |
取适量废液于试管中,加入 。 |
|
废液中含有HCl |
[解释与结论]同学们根据以上实验,讨论得出废液的主要成分是CaCl2和HCl。
[评价与反思]实验结束后,同学们对探究活动进行了如下反思:
①小强认为方案一中存在操作错误,错误的操作是 。
②小敏认为方案三不足以证明废液中含有HCl,理由是 。
③大家一致认为实验后的废液不能直接排放,理由是 (写一点)。要想从废液中得到CaCl2固体,可采用的方法是 。
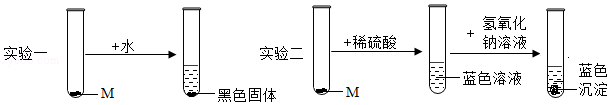
某化学实验室有一瓶黑色固体粉末M(M是纯净物),因试剂瓶标签破损无法确定其成分。为探究M的成分小军进行了以下实验,请你参与他的探究:
[猜想与假设]物质M可能是 ;
[设计与实验]取两份等量的M样品,分别进行如图的实验:
[分析与结论]
(1)从实验一小军得出M的物理性质有 (填写一种);
(2)从实验二小军推断出M的化学式是 ;
(3)实验二中②发生反应的化学方程式是 。
[拓展与延伸]探究M与稀硫酸反应的本质
(1)稀硫酸中含有水分子、氢离子、硫酸根离子等粒子,其中属于阴离子的是 (用化学符号来表示);
(2)小军分析实验一、二后认为:可能是稀硫酸中的某一种离子与M发生了反应。为确定稀硫酸中何种离子与M发生了反应,他继续设计了如图的实验进行探究:
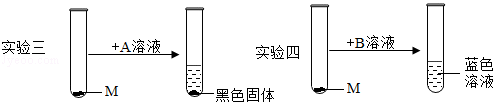
实验三中的A可选用的药品是 (填序号,下同),实验四中的B可选用的药品是 ;
硫酸钾溶液 氯化钾溶液 氢氧化钠溶液 稀盐酸
(3)小军通过上述实验证明:稀硫酸中 (用化学符号来表示)与M发生了反应;
[反思与交流]某同学优化了小军的整个实验方案,认为不需要进行实验 四 (填实验编号),就能确定M的成分,也能确定稀硫酸中何种粒子与M发生了反应。
化学课堂上,老师做了如图一的实验(网罩的作用是集中火焰,提高温度)。

(1)随着不断加热,试管①里逐渐有红色固体产生,化学方程式为C+2CuO 2Cu+CO2↑,该反应的基本反应类型属于 。同时试管②里的现象是 ,化学方程式为 。
(2)小明发现通入试管②里的气体有逸出液面的现象,怀疑试管①里还有其它气体生成,比如一氧化碳。老师首先赞扬小明有科学的质疑精神,建议在化学兴趣小组的活动中展开探究。请你也参与其中,一起探究。
[提出问题]碳还原氧化铜的反应还有一氧化碳生成吗?
[猜想与假设]猜想一:没有一氧化碳生成;猜想二:还有一氧化碳生成
[设计方案]在老师的帮助下,小明设计出如图二实验。为了提高实验效果,小明加大了反应物的用量。老师提示:先将两个开关都打开,再加热,反复挤压气球一会儿。老师这样提示的目的是 。
[进行实验]
实验操作 |
实验现象 |
实验结论 |
先按老师的提示操作,加热一会儿后,关闭开关2.待充分反应,关闭开关1,停止加热。 |
逸出液面的气体不是二氧化碳 |
|
逸出液面的气体是一氧化碳。猜想二成立。 |
[交流与提高]同学们通过对以上实验的讨论与分析,认为一氧化碳的产生至少源自两个反应:一是试管内反应物直接反应生成;二是生成物又发生反应而生成。请你写出其中一个化学方程式 。
实验中生成的二氧化碳被氢氧化钠浓溶液吸收没有明显现象,同学们想进一步检验该反应的生成物,可选用的药品有 (填序号)。
①酚酞溶液 ②氢氧化钙溶液 ③稀盐酸 ④锌粒 ⑤氯化钙溶液
[评价与反思]经过本次活动,同学们感到,正是因为小明具有 精神,我们这次活动才有了更多、更新的收获。
现有溶质质量分数为20%的NaOH溶液20g,与一定质量的稀盐酸恰好完全反应。
计算:(1)NaOH溶液中溶质的质量为 g
(2)生成NaCl的质量。
某白色固体甲的主要成分为NaCl,可能含有MgCl2、KCl、BaCl2和NaOH中的一种或几种杂质,为检验白色固体甲的成分并除去其中杂质,进行如下实验:
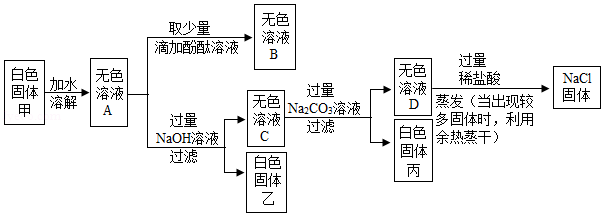
(1)写出生成白色固体丙的化学方程式 ;
(2)向无色溶液D中加入过量稀盐酸的目的是 ;
(3)分析上述实验可知,白色固体甲中一定没有的物质是 ;
(4)若用上述实验中的A、B、C、D四种溶液鉴别稀H2SO4和NaOH溶液,分别取样后,按如图所示操作进行实验,就能达到鉴别目的是实验 。

我国在2017年"世界环境日"(6月5日)确定的主题是"绿水青山,就是金山银山".华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm 3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是 g.
(2)污水中所含NaOH的质量分数是多少?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸 克才能使碳酸钠恰好完全变成硫酸钠.