已知A~E分别是铁、氢氧化钙、盐酸、碳酸钠、氯化铜中的一种,A与B反应能生成气体,E的溶液呈蓝色。它们相互之间的关系如图所示,“—”表示两种物质之间可以相互反应。请回答下列问题:
(1)E物质的化学式为 ;
(2)B与D反应的实验现象是 ;
(3)B和C反应的实质是 ;
(4)写出A与C反应的化学方程式 ,其基本反应类型是 。

重庆多地曾出现过盐井,从天然盐井中获取粗盐(含泥沙、CaCl2、MgCl2、Na2SO4等杂质)。为了除去以上杂质得到精盐,小明设计如下实验:
【提示】杂质含量较少,不考虑微溶物形成沉淀。
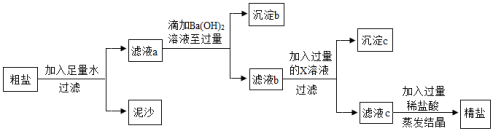
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(2)沉淀b所含物质为Mg(OH)2和 。
(3)物质X是 。
(4)滤液c中加入稀盐酸后发生中和反应的化学方程式为 。
(5)为了证明滴加的Ba(OH)2溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的有 。
A.Ba(OH)2
B.K2CO3
C.Na2SO4
D.KCl
某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生氢气的体积。
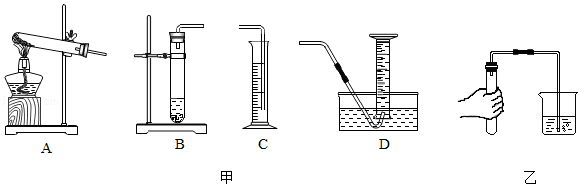
(1)已知氢气的密度比空气小,难溶于水。应选择甲图中的 装置进行制取和收集。
(2)乙图为检查发生装置气密性的操作,当观察到水中的导管口有 产生,则表示该装置气密性良好。
(3)已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到0.01)
(4)反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因 (写出两点)。
新冠肺炎疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行手和其他皮肤的消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8g/mL,水的密度约为1.0g/mL)。
请回答下列问题:
(1)H2O的相对分子质量为 ,H2O分子中H原子与O原子的个数比为 。
(2)乙醇由 元素组成,配制乙醇消毒液需要乙醇和水的体积比为 。
(3)乙醇消毒液中乙醇的质量分数约为多少?(要求写出计算过程,结果精确到0.1%)

将化学物质进行合理分类是研究物质及其变化的常用方法。
(1)以下物质的分类对于预测其化学性质没有帮助的是 (填标号)。
A.二氧化硫属于非金属氧化物
B.锌属于“氢前金属”
C.氢氧化锰属于白色固体
D.硫酸亚铁属于硫酸盐
(2)碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域,是一种微溶于水的白色固体。结合所学知识预测,Li2CO3能与 (填物质类别)反应,验证预测的实验操作与预期现象是:取Li2CO3固体于试管中, 。
(3)依据各类物质之间的反应规律,设计两种制备Li2CO3的方案(要求依据两种不同的反应规律)。完成表:
方案 |
原料1 |
原料2 |
预期反应的化学方程式 |
依据的反应规律 |
① |
Li2SO4溶液 |
|
|
两种盐反应生成两种新盐,生成物中有沉淀。 |
② |
|
|
|
|
丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
[进行实验]用如图装置(夹持仪器已略去)完成实验,记录如下:
序号 |
① |
② |
装置 |
|
|
现象 |
试管内壁有水雾 |
注入酸后,有气泡产生,石灰水变浑浊 |
[解释与结论]
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为 。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是 。
Ⅱ.探究丙酸钙防霉的效果
[进行实验]分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 |
第1组 |
第2组 |
|||||||
序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
配方 |
面粉/g |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
酵母/g |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
|
蔗糖/g |
0 |
0 |
0 |
0 |
5 |
5 |
x |
5 |
|
丙酸钙/g |
0 |
0.06 |
0.10 |
0.15 |
0 |
0.06 |
0.10 |
0.15 |
|
开始发霉时间 |
第3天 |
第4天 |
第5天 |
第6天 |
第3天 |
第4天 |
第5天 |
第6天 |
|
[解释与结论]
(3)设计第1组实验的目的是 。
(4)第2组,⑦中x为 。
(5)对比第1组、第2组实验可得到的结论是 。
[反思与评价]
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”,你是否同意此观点,并说明理由: 。
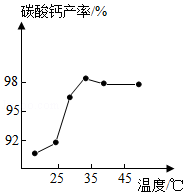
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)
人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明他们的化学性质都 。
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①)比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是 。
②近代工业上采用电解熔融氧化铝(A12O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为 : 。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17All2是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为 。
(4)钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其 (填字母序号)非常好。
A.可塑性 B.机械性能 C.抗腐蚀性能
(5)铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe=3FeC12
①铁锈的主要成分是 (填化学式):将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及 种化学反应基本类型。
②将10g表面生锈的铁钉(杂质已忽略)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6g。则原锈铁钉中铁元素的质量分数为 。
(6)利用“活泼金属”可以制得H2,H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有 (填字母序号)。
A.金属原料的成本 B.生成过程中的能耗和污染 C.金属的回收利用
NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H 2O 2NaOH+Cl 2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na 2CO 3杂质,设计如下实验方法 
注:AgCl是白色固体,难溶于水和稀HNO 3
①乙中有无色无味气体产生,证明样品中含有Na 2CO 3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO 2质量,确定因久置而变质的NaOH固体中Na 2CO 3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m 1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m 2。

①球形干燥管中不用NaOH固体而用CaCl 2固体的原因是 。
②小明同学认为(m 1﹣m 2)即为生成的CO 2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H 2SO 4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H 2SO 4的质量为 (写出计算过程,否则不得分)。
A、B、C、D是初中化学常见的不同类别(单质、氧化物、酸、碱、盐)的稳定物质。它们的转化关系如图所示(“→”表示反应能一步实现,“一”表示相连物质间能发生反应,部分反应物、生成物和反应条件均已略去),回答下列问题。
问题一:
(1)若A是磁铁矿的主要成分,写出反应②的化学方程式为: ;
(2)若B的俗名是苏打,固体C易潮解,反应③的化学方程式为: ;
(3)在(1)、(2)中,D的物质类别是 ,上述过程中没有涉及到的基本反应类型是 。
问题二:工业上冶炼1732t含铁97%的生铁,需要含杂质10%的磁铁矿石的质量是多少?(写出计算过程,结果保留一位小数。)

化学知识与应用
(1)铝制品耐腐蚀的原因是 (用化学方程式表示);
(2)在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生成轻质碳酸钙:将石灰石煅烧后加水制成石灰乳,净化后与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理:
① ; ② ;③ 。
化学基础与常识
(1)保持水的化学性质的最小粒子是 (用符号表示,下同);
(2)NH4NO3水溶液中大量存在的阳离子是 ;
(3)碳单质可用于冶金工业,是利用了它的 性;
(4)CuCl2溶液中含有少量HCl,为除去少量HCl可加入 (多选,填序号)。
A.Cu B.CuO C.Cu(OH)2 D.NaOH
化学试剂厂三个车间排放的废液中分别含有的溶质如下:
甲 |
乙 |
丙 |
Ba(OH)2、NaOH |
NaCl、Na2CO3 |
HCl、NaCl |
按照不同的方式处理,可以得到不同化学产品,从而充分利用资源,变废为宝。
(1)方案一,甲车间废液中加入适量的Na2CO3 溶液,可分离回收Ba(OH )2 和 NaOH,写出该反应的化学方程式 ;
(2)方案二,乙、丙两车间的废液按适当比例混合后,可得到一种溶质为 的中性溶液;
(3)方案三,将三个车间的废液样品混合,过滤。得到无色溶液和白色沉淀。无色溶液中一定含有NaCl,为确定可能含有的溶质,设计下列实验,其中能达到目的是
A. 若只加入MgSO4 溶液,能观察到明显现象
B. 若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,都能观察到明显现象
C. 若加入过量的中性BaCl2 溶液后,再滴加酚酞溶液,都能观察到明显现象
(4)方案四,按照下列方式将三个车间的废液按适当比例混合(假设能反应的物质均恰好完全反应,且中间过程未过滤),最终只生成BaCO3 沉淀和NaCl 溶液的是
以稀盐酸和稀氢氧化钠溶液为例,探究酸和碱的中和反应,实验如图所示实验过程分4次往烧杯中滴加B,每次滴加后测得烧杯中溶液的pH及温度如表
| 滴加B的次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 溶液的pH |
13.4 |
11.7 |
6.4 |
3.1 |
| 溶液的温度/℃ |
28.9 |
32.8 |
31.9 |
31.8 |
(1)表中pH的变化说明B是 (填物质名称)。
(2)表中温度的变化说明中和反应是 (填放热或吸热)反应,该反应的化学方程式是 。
(3)滴加B前A显 色。
(4)第4次滴加B后,烧杯中的溶液呈 (填酸或碱)性此时溶液中所含的溶质(酚酞不计)有 (写化学式),设计实验方案验证溶液中所含的溶质: 。

某固体粉末由Mg、MgO和Mg(OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图所示的装置(固定装置省略)
[信息资料]本实验条件下,氢气密度为0.09g/L。
[实验过程]
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测定生成气体的体积为55.6mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生产沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
[回答问题]
(1)该套装置气密性的检查方法是 。
(2)①使样品与硫酸充分反应的正确操作是 (填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
②判断样品完全反应的现象是 。
(3)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是 。
通过步骤Ⅲ计算,样品中镁元素的总质量为 g。
②结论:该样品中的成分是 。
[反思]
(4)该化学小组同学经过讨论得到以下结论,正确的有 (填标号)。
A.利用该实验方案,能计算出样品中各物质的质量
B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量。
