现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。计算:
(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%);
(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)。
取硫酸钠和氯化钠的混合物15g,加入180g水使其完全溶解,再加入100g氯化钡溶液恰好完全反应,过滤,得271.7g滤液(不考虑实验过程中质量的损失)。计算:
(1)该混合物中硫酸钠的质量分数(计算结果精确到0.1%);
(2)反应后所得滤液中溶质的质量分数(计算结果精确到0.1%)。
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一

①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
小王同学想测定某Cu﹣Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为 g。
(2)计算合金中铜的质量分数。

某同学用锌和稀硫酸做了如下实验,并进行相关的定量分析.将一定量的锌放入试管中,向其中加入98g质量分数为10%的稀硫酸,恰好完全反应.
(1)请计算生成氢气的质量(写出计算过程).
(2)通过已知数据还能求出的量有 (填字母,符合题意的选项都选).
a.参加反应锌的质量 b.生成硫酸锌的质量
c.稀硫酸中水的质量 d.反应后溶液中溶质质量分数.
合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程.
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| |
第一次 |
第二次 |
第三次 |
| 加入稀盐酸的体积(ml) |
15 |
15 |
15 |
| 生成氢气的质量(g) |
0.04 |
m |
0.02 |
试求:
(1)m的数值 .
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品13.3g于烧杯中,加水完全溶解,然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见表.
加入氯化钡溶液的质量/g |
20 |
40 |
80 |
生成沉淀的质量/g |
1.97 |
3.94 |
5.91 |
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量.
(2)13.3g氢氧化钠样品变质前的质量.(已知:Ba的相对原子质量为137)
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取5g样品于烧杯中,加入30g水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,完全反应后,生成沉淀1.97g,求:
(1)样品中碳酸钠的质量分数。
(2)反应后所得溶液中氢氧化钠的质量。
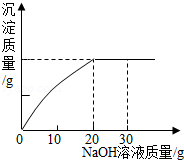
某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验:取废水300g,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图,请分析计算:
(1)实验中生成氢氧化铜的质量为 g;
(2)300g该废水中硫酸铜的质量;
(3)该废水中硫酸的溶质质量分数。(计算结果精确到0.1%)

某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量.他们准确称量两份质量各为10.0g的铁粉样品,分别进行如下操作:
(1)如图所示甲同学记录天平砝码和游码的数据为54.0g.将气球中的10.0g铁粉样品加入到盛有过量的稀硫酸的锥形瓶中,反应停止后,天平是否平衡(不考虑空气浮力) (填“是”或“否”);要想获取实验的相关数据,后面必须的操作是 (假设气球不破裂且能恢复原状).
A、打开弹簧夹a放出气体 B、取下砝码
C、向右拨动游码至天平平衡 D、向左拨动游码至天平平衡
(2)乙同学把10.0g铁粉样品加入到足量的硫酸铜溶液中,充分反应后过滤、洗涤、干燥、称量,得到固体10.8g,计算该样品中铁单质的百分含量.(写出计算过程)

实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数.请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)

(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好 时,停止滴液,反应所消耗稀盐酸的质量为 g.
(2)通过计算确定该瓶烧碱溶液的溶质质量分数.(写出计算步骤)
(3)问题讨论:小红做同样的实验得到的结果比小杰得到的结果偏小,从实验操作的角度分析产生这种误差的原因可能是 (填写一条即可)
某同学在实验室发现一瓶标签残缺的硫酸铜溶液。为了测定此溶液的溶质质量分数,他取出50g该溶液,向其中逐滴加入溶质质量分数为20%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示。请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液 g时,硫酸铜与氢氧化钠恰好完全反应,此时溶液中的溶质为 (填化学式)。
(2)计算此硫酸铜溶液中溶质的质量分数(写出解题过程)。
为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

已知某溶液中的溶质可能是HCl、NaOH、CaCl 2中的一种或两种,为确定该溶液中溶质的成分及含量,进行以下实验。
(1)取少量溶液与试管中滴入2滴无色酚酞,酚酞不变色,溶液中一定不存在 。
(2)为了进一步测定成分及含量,重新取120g溶液于烧杯中,逐滴加入20.0%的Na 2CO 3溶液,测得滴加溶液的质量与产生沉淀的关系(图1)和滴加溶液的质量与烧杯中溶液的pH关系(图2)。
(已知:向盐酸中滴加碳酸钠溶液发生反应为:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑;CaCl 2溶液呈中性。)回答下列问题:

①该溶液中溶质的化学式为 。
②计算溶液中各溶质的质量分数。(写出计算过程)
③m 1= g;m 2= g。
化学兴趣小组的同学为体验加热固体制取气体的操作步骤和方法,利用6g氯酸钾和2g二氧化锰的混合物加热(化学反应方程式:2KClO 3  2KCl+3O 2↑)制取氧气.
2KCl+3O 2↑)制取氧气.
(1)实验结束后,甲同学认为氯酸钾可能未分解完全,又设计进行了下面的实验:
实验1:将实验加热后的残留物加水至充分溶解,过滤;
实验2:向实验1的滤液中滴加硝酸银溶液至不再产生沉淀,过滤、干燥,称得沉淀质量为5.74g.
小资料:①二氧化锰不溶于水 ②AgClO 3易溶于水
甲同学分析实验过程,其中仅涉及两步化学反应:
2KClO 3  2KCl+3O 2↑ KCl+AgNO 3═AgCl↓+KNO 3
2KCl+3O 2↑ KCl+AgNO 3═AgCl↓+KNO 3
推出两反应间存在KClO 3→KCl→AgCl↓物质转化关系和质量比例关系.
请你利用上述关系,通过计算帮甲同学判断KClO 3是否完全分解? (要求:简单写出计算过程、说明判断依据,计算结果精确到0.1)
(2)乙同学对甲同学的方案提出质疑:认为通过称量加热后残留物质量,利用加热前后质量差进行计算,同样达到甲同学的实验目的.你赞同乙同学的观点吗?说明理由: .