实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后(固体质量不再变化时)固体变为9.04g,再将固体加水充分溶解、过滤、干燥得到1.59g黑色固体。求10g剩余固体混合物中氯元素的质量分数为
| A.7.1% | B.35.5% | C.28.4% | D.42.6% |
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
(6分)某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验。取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液。测得沉淀质量与所加入的氢氧化钠溶液的质量关系如下图: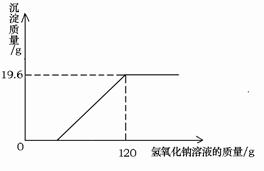
根据所得数据计算:
(1)500g该废水中硫酸铜的质量。
(2)该废水中硫酸的溶质质量分数。
为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 |
t1 |
t2 |
t3 |
t4 |
t5 |
| 烧杯和药品质量/g |
516.6 |
507.8 |
m |
503.4 |
503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
(8分)钢铁的生产和使用是人类文明和社会进步的一个重要标志。
(1)每年钢铁锈蚀造成巨大的损失,铁制品锈蚀的主要原因是
。
(2)校课外兴趣小组取潍坊某钢铁厂生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的硫酸溶液中,充分反应后,测得的实验数据如下表所示:(已知:在标准状况下,22.4L H2的质量为2g)
| 实验序号 |
1 |
2 |
3 |
4 |
| 生铁样品的质量/g |
2.88 |
5.76 |
9.24 |
10.28 |
| 生成H2的体积(标准状况下)/L |
1.12 |
2.24 |
3.36 |
m |
通过计算回答下列问题:
①上述表格中m的值为 ;
②根据表中数据计算硫酸溶液中H2SO4的质量分数。
宇航员在太空舱中,往往可利用自己呼出的二氧化碳与过氧化钠粉末作用来获得所需的氧气,(反应方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2)。假如某宇航员在某次太空飞行中预计消耗氧气480kg,请计算该宇航员在太空舱中至少应准备的过氧化钠的质量。(请写出计算过程)
为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20 g,逐滴加入氢氧化钡溶液30 g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。过滤后得滤液47.67 g。请你通过计算,求出氢氧化钡溶液的溶质质量分数。可能用到的相对原子质量:H—1 O—16 S—32 Ba—137
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g。
试计算:
⑴产生二氧化碳气体的质量是 g。
⑵该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品
,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和
溶液。反应过程用精密仪器测得烧杯内混合物的质量(
)与反应时间(
)关系如下图所示。
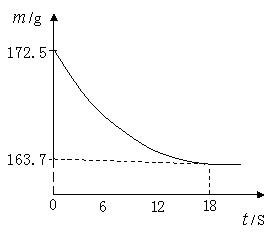
求:(1)生成
的质量。
(2)该纯碱样品中
的质量分数。
(3)根据条件,此题还可求算出下列中的(只填字母标号,不计算,可多选)。
| A. | 该纯碱样品中 的质量分数; |
| B. | 反应所用稀盐酸的溶质质量分数; |
| C. | 反应后所得溶液中 的质量分数; |
| D. | 反应生成水的质量。 |
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应。过滤干燥后,称得沉淀质量为19.7g。请你帮助计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)。
某化工厂生产的氧化亚铜(Cu2O)产品中常含有10%的金属铜。现准备用40 t该产品生产10%的硫酸铜溶液。已知:Cu2O+H2SO4===CuSO4+Cu+H2O
求:所需溶质质量分数为20%的稀硫酸质量和加水的质量。
小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:
称取10g赤铁矿样品,加入到烧杯中,再加入92.5g的稀硫酸,恰好完全反应。过滤得滤渣2.5g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?
(2)上述反应所得滤液中溶质的质量分数?
向某铁粉样品中,加入溶质质量分数为10%的硫酸铜溶液160 g,恰好完全反应,样品中杂质不溶于水也不与硫酸铜反应。请结合下图提供的数据计算。
(1)a的数值。
(2)向不饱和滤液中加入40.8 g水,求所得溶液中溶质的质量分数.
某学校开展综合实践活动,组织学生考察学校附近化工厂的污水处理情况,了解到该化工厂排放的污水中含有盐酸,经检测,污水中HCl的质量分数为0.0073%,处理污水所用的原料是熟石灰。
(1)要中和1000 t污水中的HCl,至少需要熟石灰的质量是多少?
(2)中和反应在生产生活中有广泛的应用,请你再举一例。
将 氯化钙溶液和 碳酸钠溶液混合后,恰好完全反应.过滤后得到 溶液.请计算:
(1)反应后生成沉淀的质量.
(2)过滤后所得溶液中溶质的质量分数.