高锰酸钾是锰的重要化合物和常用的氧化剂.如图所示是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)写出实验室用KMnO4制备气体的一个化学方程式。
(2)操作Ⅰ的名称是。
(3)上述流程中可以循环使用的物质有(至少填两种)
(4)用结晶法分离KMnO4、K2CO3两种物质,进行该操作前需查阅的资料是,KMnO4粗品制成精品,须进行洗涤再干燥,检查是否洗净的具体操作是。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为。
(3)操作①中过滤时,要趁热进行的原因是,过滤后得到的固体中一定含有的物质是。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是(填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
海洋是人类宝贵的自然资源,从海水中可以得到粗盐。
(1)称取5.0g粗盐,逐渐加入10mL水中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止。还需要进行的实验步骤依次为:①称量剩余粗盐、②、③、④称量精盐、⑤计算产率。
(2)下图是某工厂利用粗盐水生产纯碱的工艺流程图。
①下列说法正确的是(填字母)。
| A.流程Ⅰ中加入溶液的顺序不能改变 |
| B.流程Ⅰ将粗盐水中的SO42-、 Mg2+、Ca2+转化为沉淀 |
| C.流程Ⅰ后过滤得到三种沉淀 |
| D.流程Ⅲ中发生的是分解反应 |
②流程II中发生的主要反应为NH3+CO2+H2ONH4HCO3 ,
NH4HCO3+NaClNaHCO3↓+NH4Cl 。
20℃时,向100g水中加入11.7g NaCl和15.8g NH4HCO3,充分反应后,理论上从溶液中析出晶体的质量为g(20℃时,NaHCO3的溶解度为9.7g, NH4Cl的溶解度为37.2g)。
提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是(填序号)。
| A.研钵 | B.量筒 | C.烧杯 | D.试管 |
(2)完成该实验部分操作过程如图所示,其有明显错误的是(填字母序号)。
(3)为尽量减少蒸发时发生飞溅,操作⑤中除连续搅拌外还可采取等措施。
(4)用提纯得到的“精盐”配制了50 g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有(填序号)。
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
(5)粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质;为了得到较纯净的氯化钠,除去泥沙的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种;反应中所加试剂均过量)。
①白色沉淀含有物质的化学式为;
②在得到的滤液中加入过量盐酸的目的是;
③选用蒸发结晶法而不用降温结晶法的理由是。
工业上的常说“三酸两碱”是重要的化工原料。实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”。
查阅资料:含NO3的物质见光易分解,一般储藏在棕色试剂瓶中。
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸。他的做法是:
①直接观察试剂瓶颜色,棕色试剂瓶E内的是(填名称);
②分别打开C、D瓶的瓶塞,观察到,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸。
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图。
注:整个框图中每个化学反应涉及的物质已全部给出。
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题。
Ⅰ.写出②反应的化学方程式。
Ⅱ.框图中的①反应所属的反应类型是。
Ⅲ.请选用一种物理方法鉴别A、B瓶内的物质:,
在实验室中能否通过滴加酚酞试液来区别A、B的溶液?(填“能”或“否”),为什么?。
某同学欲用①NaOH溶液、②Na2SO4溶液、③Na2CO3粉末、④铁钉、⑤Ba(NO3)2溶液分别与稀H2SO4混合来验证复分解反应发生的条件。(如下图)
(1)从物质类别和构成的角度分析,铁钉、与稀H2SO4混合的实验没有必要做。
(2)上述物质中能与稀硫酸发生复分解反应,但是没有明显现象;为证明两者能够反应,你的做法是;
(3)Na2CO3粉末和稀H2SO4能发生反应,是因为反应中有生成;
(4)依据常见酸、碱、盐的溶解性表(室温),某物质能与稀H2SO4发生中和反应,同时生成水和沉淀,写出反应的化学方程式。
有一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙、氯化钡中的一种或几种物质组成。为探究该白色固体的组成,某小组取适量样品按下列流程进行实验。请回答下列问题: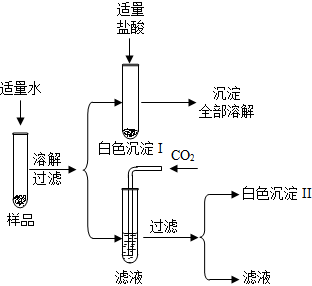
(1)白色沉淀Ⅰ与稀盐酸反应的化学方程式。
(2)白色沉淀Ⅱ的化学式。
(3)原白色固体中含有的物质。
利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会(填"增大"、"不变"或"减小")。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是(填"引流"或"加快溶解")。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
| A. | 称量及量取 | B. | 计算 | C. | 溶解 | D. | 装瓶贴标签。 |
其正确的实验步骤顺序是(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是g(计算结果精确到0.1)
某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如下:
请认真分析流程中各步骤的信息作答:
(1)溶剂
是;
溶液中溶质的化学式为:。
(2)蒸发操作的目的是除去(填物质的化学式)。
(3)写出加入过量
溶液反应的化学方程式:。
A-F为初中化学常见物质,他们由H、C、O、Cl、Na、Ca中的元素组成。
①取D溶液进行实验,操作及部分现象如上图所示,其中E是由两种元素组成的化合物。D与F反应的化学方程式为。
②关于整个实验下列说法正确的是。
A、E溶液一定是盐酸溶液
B、烧杯三中的无色溶液一定是中性
C、烧杯三的溶液中一定有阳离子是Na+,Ca2+
D、烧杯三中的溶质存在的情况只有一种
(6分)已知A、B、C、D、E、F、G、H、M、N均为初中化学中常见的物质,其中A、C、D、M、F为氧化物,组成A与C的元素种类相同;H为可溶性碱;固体X在B中充分燃烧可生成无色气体D;E为常用建筑材料的主要成分。各物质之间的相互关系如下图所示(部分反应条件和生成物已省略(。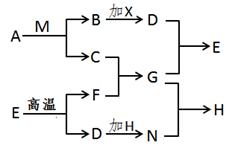
(1)物质A的化学式为:_________;
(2)写出G和N反应的化学方程式_____________________________;
(3)物质F的俗称为__________,它与C反应的现象为_____________;
(4)该转化过程中没有涉及到的基本反应类型为_______________。
请用所学化学知识解释下列原理。
(1)上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺。活性炭在此起_____ 作用。
(2)酸雨造成的危害主要有:①腐蚀建筑物;② 等。解决酸雨的措施有 等。
(3)小华的爸爸发现自己种植的棉花叶面发红、发黄,且植株比别人种植的棉花明显矮小,出现上述情况你认为应施用 肥。请用化学方程式表示草木灰与碳铵不能混合施用的原因 。
(4)下图中“──”表示两端的物质间能发生化学反应,其中X是初中化学中常见的化合物且具有挥发性,请回答:
①试写出X与Fe2O3反应的化学方程式 。
②试写一个工业上制取X的反应 。
现有以下六种物质:硝酸钾、小苏打、铝、石墨、天然气、氮气。根据下列要求用化学式填空:
(1)可充入食品包装袋用于防腐的是;
(2)发酵粉的主要成分之一是;
(3)可作干电池电极的是;
(4)可作燃料,其主要成分是;
(5)其组成元素是地壳中含量最高的金属元素;
(6)可作复合肥料的是。
实验是实现科学探究的重要途径。请回答以下有关化学实验的问题:
(1)仪器X的名称是。
(2)过氧化钠(Na2O2)是一种淡黄色粉末,在通常情况下能分别与CO2、H2O、HCl发生反应,生成O2。为了验证CO2跟Na2O2反应生成的气体是O2,某化学兴趣小组同学设计了图中所示装置。
①用A装置制得的CO2中常混有H2O和HCl气体,设计B、C装置的目的是净化CO2气体。其中B装置的作用可用化学方程式表示为.C装置瓶内的液体是。
②E装置中氢氧化钠溶液的作用是吸收没有反应的CO2,发生反应的化学方程式为.
③如何验证CO2和Na2O2反应严生的气体是O2?
(3)硫酸铜常用作农业杀虫剂,如图是利用含铁废铜料生产硫酸铜的工艺。
反应③的化学方程式为;
途径Ⅱ中,Cu+2H2SO4(浓) CuSO2+SO2↑+2H2O.
CuSO2+SO2↑+2H2O.
从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点是(写一条)。
(4)某化学兴趣小组为测定石灰石样品中碳酸钙的质量分数,进行了如下实验探究:取5g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(杂质不溶于水,也不与稀盐酸反应),放出二氧化碳气体质量与加入稀盐酸的质量关系如图所示。计算:该石灰石样品中碳酸钙的质量分数。