除去
中混有的细砂,并利用得到的部分
配制溶液,实验过程如图所示:

(1)步骤Ⅱ的操作名称是;
(2)蒸发时,所用的仪器有铁架台(带铁圈)、、蒸发皿和玻璃棒;
(3)配制
质量分数为6%的
溶液,需
;
(4)下列情况对所配制溶液质量分数无影响的是
A.得到的
未完全干燥
B.用量筒量取水时,仰视读数
C.配好的溶液装瓶后,烧杯内有溶液残留.
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的
、
、
M等,工艺流程

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是
、
和
,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式。该反应的基本类型是.
(4)"滤液3"之前加入锌粉的目的是.
(5)"滤液3"之后的操作依次为、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于×100%。
下表列出了部分酸、碱、盐在20℃时的溶解性.
请依据上表,按要求回答下列问题:
(1)盐酸的一条物理性质__________。
(2)氯化钙溶液与硝酸钠溶液_________(填“能”或“不能”)发生反应。
(3)碱和盐反应时,反应物一般必须都是可溶的.请写出一个碱和盐反应的化学方程式:
(4)NaOH和Ba(OH)2是两种可溶性碱,其溶液均为无色.请写出三种能鉴别这两种物质的试剂名称或化学式 __________________ 。
燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:

请回答下列问题:
(1)二氧化硫中硫的化合价是。
(2)用熟石灰中和稀硫酸的化学方程式是。
(3)亚硫酸(
)被空气中氧气氧化为硫酸,写出反应的化学方程式。
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比--与温度、烟气中
浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 |
温度/℃ |
烟气中 浓度/ | 脱硫率/% |
| I |
23 |
2.5% |
99.5 |
| II |
23 |
3.2% |
97.1 |
| III |
40 |
2.5% |
94.3 |
由表中实验数据可得出的结论是。
(5)目前,科学家正在研究在一定条件下将乙烯(
)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:
与
反应生成
第二步: 与 反应生成
第三步:
与
反应生成
和
。
①反应中
的作用是。
②除去二氧化硫的总反应的化学方程式是。
海水淡化可采用膜分离技术.如图一所示,对淡化膜右侧的海水加压,在其左侧得到淡水.其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
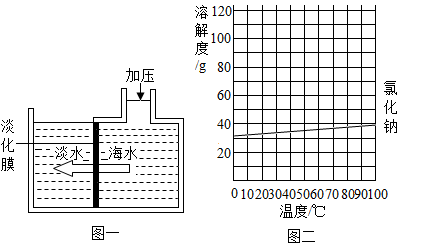
请回答:
(1)采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。
(2)对淡化膜右侧的海水加压后,海水中溶质的质量分数会(填"增大"、"减小"或"不变")。
(3)海水中含有大量的氯化钠,图二是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是结晶(填"降温"或"蒸发")。
水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)区分软水和硬水的试剂是 。
(2)采用如图所示的“淡化膜渗透法”淡化海水,淡化膜能使水分子通过,其他离子不能通过。这一淡化过程属于 (填“物理变化”或“化学变化”)。 
(3)将一包含有氯化钠、氯化钙和泥沙的混合物,通过如下操作可得到氯化钠。
【资料:CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl 】
①操作I的名称是 ,加入Na2CO3溶液的目的是 。
②若用溶液B配制100 g16%的氯化钠溶液,主要步骤是:计算(需再加入氯化钠和水的质量分别是 、 )、称量、量取、 、装瓶贴标签。
碳酸钡(化学式为BaCO3)广泛应用于显像管、陶瓷、光学玻璃等行业。有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如下图所示。
【已知】:1、碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的碱,这两种碱均可以和二氧化碳反应。
2、下表所示的是两种碱在不同温度下的溶解度。
| 温度/℃ |
0 |
40 |
80 |
| Ca(OH)2溶解度/g |
0.187 |
0.141 |
0.094 |
| Ba(OH)2溶解度/g |
1.67 |
8.22 |
101.4 |
(1)写出水浸池中氧化钙与水反应的化学方程式: 。
(2)以下相关说法错误的是
A.焙烤炉中添加焦炭粉和热空气是为了维持炉内反应所需的高温状态
B.焙烤炉内只涉及分解反应
C.废渣需要经过洗涤才能弃渣,是为了保护环境,同时为了提高产率
D.该工艺流程可以减少CO2气体的排放,控制温室效应
(3)除了水之外,进入分离池中的物质是 ,请你根据所给两种碱的溶解度推测分离池中操作②的步骤是 (选填“降温”、“加热”)、过滤。
(4)写出由溶液B制取产品碳酸钡的化学方程式: 。
某同学欲用①NaOH溶液、②Na2SO4溶液、③Na2CO3粉末、④铁钉、⑤Ba(NO3)2溶液分别与稀H2SO4混合来验证复分解反应发生的条件。(如下图)
(1)从物质类别和构成的角度分析,铁钉、 与稀H2SO4混合的实验没有必要做。
(2)上述物质中 能与稀硫酸发生复分解反应,但是没有明显现象;为证明两者能够反应,你的做法是 ;
(3)Na2CO3粉末和稀H2SO4能发生反应,是因为反应中有 生成;
(4)依据常见酸、碱、盐的溶解性表(室温),某物质能与稀H2SO4发生中和反应,同时生成水和沉淀,写出反应的化学方程式 。
科学兴趣小组在调查一化工厂时,发现有个车间排出的废水澄清透明,呈黄色.为测定该废水中所含的物质,他们进行如下实验(假设能发生的反应均恰好完全反应):
(1)用pH试纸测试,测得pH为2.
(2)取一定量废水溶液,加入Ba(NO3)2溶液,无现象.
(3)另取一定量废水溶液,加入AgNO3溶液后,过滤,得到白色沉淀A和滤液.
(4)向滤液中加入NaOH溶液,得到红褐色沉淀B.
由此可知:该废水溶液呈 性;所得的红褐色沉淀B为 ;废水溶液中肯定含有的盐是 .
对知识的归纳和总结是学好科学的重要方法.在学习了酸碱的性质后,小红同学总结了稀盐酸和氢氧化钙的化学性质(如图),


(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成____________色
(2)利用氢氧化钙与碳酸钠反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式______________________.
(3)利用稀盐酸的化学性质,可以去除铁锈,请写出方程式_______________________
(4)老师告诉同学们:对于酸和盐的反应,可以用厨房中的常见物品进行实验,其中能发生反应的两种物品是 和 (填名称或俗称)。
(5)工业上采用石灰浆雾滴技术除去废气中的二氧化硫,在此对石灰浆进行雾化处理的目的是________________________
实验室有一瓶无色溶液,老师告诉同学们该溶液可能是
溶液、
溶液、
溶液中的一种,请你和同学们一起来参与探究,并回答问题:
(1)取少量该溶液于试管中,滴加酚酞试液,溶液变红色,则原溶液不可能是溶液;
(2)另取少量该溶液于试管中,滴加
溶液,产生(填实验现象),则该溶液为
溶液,其反应的化学方程式为。
某白色固体由
、
、
、
中的三种组成,取样后加入足量的水,充分搅拌后,有白色沉淀生成,则原固体混合物的组成可能有(填序号)
①
、
、
②
、
、
③
、
、
④
、
、
过氧化钙晶体﹝
﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:

(1)气体
是
,其名称是;将过氧化钙晶体与溶液分离的方法是。
(2)反应
需控制温度在
,可将反应容器放在中,该反应是化合反应,反应产物是
,请写出化学方程式。获得的过氧化钙晶体中常含有
杂质,原因是。
(3)
的相对分子质量为,过氧化钙晶体﹝
﹞中
、
元素的质量比为。
(4)为测定制得的过氧化钙晶体中
的质量分数,设计的实验如下:称取晶体样品
,加热到
充分反应(方程式为
,杂质不发生变化),测得生成氧气的质量为
,请计算样品中
的质量分数(
相对分子质量为
),写出必要的计算过程。
(1)冬季,大雪覆盖路面,给交通造成很多麻烦,散撒融雪剂可以使雪很快融化,有效地清除交通雪障。除使用融雪剂外,常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的,锰钢属于 (填写序号字母)。
| A.合成材料 | B.合金 | C.金属材料 | D.复合材料 |
(2)氯化钙是常用的融雪剂。工业上以碳酸钙(含有少量Na+、Mg2+、Fe3+等杂质)生产氯化钙的主要流程如下:
①滤渣的主要成分是 、 (填化学式);
②加盐酸酸化,其目的之一是除去未反应的氢氧化钙,写出反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
(3)已知盐酸盐(金属氯化物)跟AgNO3溶液反应生成白色沉淀。某公司生产的融雪剂由NaCl、NaNO3、MgCl2、CuSO4中的两种物质组成。小明为探究其成分,设计并完成下列实验:
请你推断:融雪剂中一定不含的物质是 (填写名称),融雪剂中一定含有的物质是 (填化学式)。
【改编】只用C、O、Cl、H、Na、Ca、Cu七种元素的一种或几种,按要求填空:
(1)各写出一种物质的化学式:
①能与水反应生成酸性物质的氧化物_________
②不含氧元素的酸__________
③用于建筑的碱__________
④含有四种元素的盐__________
(2)各写出一个化学方程式:
①有水参与的分解反应_______________ _____________(2分);
②放出极多热量的化合反应_______________ ____________(2分);
③有水生成的置换反应_______________ _____________(2分);
④有碱生成的复分解反应_________________ __________(2分)。