现有A、B、C、D四种没有标签的无色溶液,分别是稀盐酸、碳酸钠溶液、澄清的石灰水、氢氧化钠溶液中的一种,为了鉴别它们进行以下实验,实验步骤及现象如下:
(1)先分别取少量的四种溶液样品于洁净的试管中,再分别向四种溶液中滴加适量紫色石蕊溶液,结果A溶液显红色,B、C、D溶液显蓝色;
(2)B、C溶液混合后有白色沉淀产生、根据现象回答下列问题:
①A物质是 (填物质名称);D溶液中溶质是 (用化学式表示);
②B和C溶液混合发生反应的化学方程式 ;
③在A、B、C、D四种溶液中,若其中两种溶液混合能发生反应但无明显现象,加入另一种溶液,有白色沉淀产生,则加入另一种溶液之前,两种溶液混合反生反应的化学方程式 、
根据如图回答问题.

(1)图1锥形瓶中充满二氧化碳,将分液漏斗中的氢氧化钠溶液加入到瓶中,观察到的现象是 .
(2)配制一定质量10%的稀硫酸,若量取浓硫酸时仰视读数,得到溶液中溶质的质量分数会 (填“大于”、“小于”或“等于”)10%;图2操作中用玻璃棒搅拌的目的是 .
(3)图3实验中铜片上的白磷燃烧而红磷不燃烧,说明了可燃物燃烧满足的条件是 ;烧杯中热水的作用是 和提供热量.
小明同学为探究“Na2CO3溶液与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如下表:
| 试剂1 |
试剂2 |
混合前温度/℃ |
混合后温度/℃ |
|
| 35毫升稀盐酸 |
25毫升Na2CO3溶液 |
20.0 |
第1次 |
24.2 |
| |
|
|
第2次 |
24.0 |
| 第3次 |
24.4 |
请你帮助填写相关内容:
(1)写出该实验涉及的化学反应方程式 ;
(2)该实验中所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是:
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是 (选填:“放热“或“吸热“)
向盛有10mLNaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
| 加入稀盐酸的体积/mL |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
| 烧杯中溶液的pH |
12.9 |
12.7 |
12.5 |
12.3 |
11.9 |
7.0 |
2.1 |
1.9 |
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显 色;当加入稀盐酸的体积为14mL时,溶液显 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有: 。
根据"在氢氧化钠溶液中滴加稀盐酸"的实验(如下图),回答下列问题:
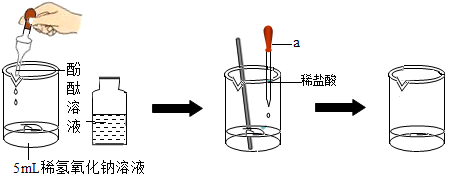
(1)仪器
的名称是。
(2)使用玻璃棒搅拌的目的是。
(3)酚酞溶液的作用是。
(4)氢氧化钠与盐酸恰好完全反应的现象是。
请根据下表回答有关问题
(1)写出纯碱的化学式 ;
(2)表中物质属于氧化物的是: ;属于盐的是: ;
| 序号 |
① |
② |
③ |
④ |
| 物质 |
醋酸 |
生石灰 |
熟石灰 |
纯碱 |
| 化学式 |
CH3COOH |
CaO |
Ca(OH)2 |
Na2CO3 |
(3)上述四种物质放入相等的水中,所得的溶液中pH最小的是 ;
(4)CH3COOH(其性质类似于盐酸)可以与表中 物质发生化学反应.
节假日或双休日,去郊游野炊实为一大快事。但野炊的过程中可能会遇到下面一些问题,你将如何处理呢?
(1)在“灶”上悬挂野炊锅时,应调节野炊锅到合适的高度.你觉得原因可能是
(2)野炊食谱如下:主食:馒头;配菜:烤火腿、鲫鱼汤、五香豆干。从营养角度来看,你可以再准备一样 (填字母序号);
A.炒鸡蛋 B.牛奶 C.黄瓜 D.烤野兔肉
(3)若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),下列物质可用于涂抹以减轻疼痛的是(填字母)
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
对知识的归纳和总结是学好化学的重要方法.在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应.

(1)为了检验反应③能够发生,你可选择下列哪些物质?
A HCl B FeCl3 C CaO D KOH E Na2CO3
(2)农业上常用氢氧化钙来改良酸性土壤,是利用其化学性质中的 (填序号).
如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线.
(1)氢氧化钠和盐酸恰好完全反应时,溶液的pH 7(填“<”、“>”或“=”).
(2)当滴入溶液的体积为15mL时所得溶液中的溶质为 (写化学式),若在此溶液中滴入石蕊试液,溶液呈 色.
下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na 2 CO 3 + H 2 SO 4 ="Na" 2 SO 4 + H 2 O + CO 2 ↑;
氧化钙(俗称生石灰)与水反应放热。

(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| |
滴管甲 |
烧杯① |
滴管乙 |
烧杯② |
| 试剂 |
H 2 O |
|
|
MnO 2 |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。
将生锈的铁钉放入过量的盐酸中,首先看到铁锈溶解,溶液呈 色,这是因为(用化学方程式表示) ,不一会儿,又看到溶液中有 的现象,这是因为(用化学方程式表示) .
现有七种物质:
①硝酸钾②小苏打③熟石灰④聚乙烯⑤生石灰⑥氯化钙⑦碳酸钙.
试按下列要求用序号填空:
(1)常用作干燥剂的是;
(2)常用作发酵粉主要成分的是;
(3)可以制作食品包装袋的是;
(4)常用作改良酸性土壤的碱是。
某同学选择“金属和酸反应的快慢与什么因素有关”的课题开展探究.下表是他们分别用接触面积、质量相同的金属丝和足量稀酸反应的三组实验数据:
| 实验编号 |
反应物 |
酸的质量分数% |
反应的温度℃ |
金属丝消失的时间s |
| ① |
铝丝和稀盐酸 |
5 |
20 |
450 |
| ② |
铝丝和稀盐酸 |
10 |
20 |
240 |
| ③ |
铝丝和稀盐酸 |
10 |
30 |
65 |
| ④ |
铁丝和稀盐酸 |
10 |
30 |
125 |
| ⑤ |
铝丝和稀硫酸 |
10 |
30 |
超过1000 |
(1)实验开始前都需要用砂纸充分打磨金属,目的是:
(2)对比试验 可知,金属和酸反应的快慢还与金属的种类有关.
(3)本通过测量 来反应金属和酸反应的快慢.
(4)通过比较实验①和②可得出实验结论: .
有一种干燥剂,它的主要成分是生石灰,其化学式为 。将该干燥剂放入水中搅拌,其中主要反应的化学方程式是 ,滴入无色酚酞显 色。反应后,取出少量清夜于试管中,再向这清液中吹气,有关的化学反应方程式为 。
现有
| A. | 干冰 | B. | 熟石灰 | C. | 食盐 | D. | 生石灰四种物质 |
请按照下列要求选用物质的序号填空:
(1)可用于人工降雨的是。
(2)可作食品干燥剂的是。
(3)生活中作调味品的是。
(4)用来降低土壤酸性的碱是。