实验中,小红误将氢氧化钠溶液当成酸滴加到金属铝中,结果发现也有气泡产生,为了解该气体的成分,实验小组进行了以下探究
【提出猜想】小红猜想是氧气;小敏猜想是氢气;小雨猜想是二氧化碳
其他同学认为小雨的猜想是错误的,理由是;
【进行实验】利用图I所示的装置分别进行实验

(1)小红:反应一段时间后,将带火星的木条放在a处,观察到,则她的猜想错误。
(2)小敏:①用图II所示装置干燥从a导管出来的气体,将管口a与(填"b"或"c")端管口连接。

②反应一段时间,点燃干燥的气体,通过对现象的分析,得出他的猜想正确。
【得出结论】铝和氢氧化钠反应生产氢气和偏铝酸钠(NaAlO2),
反应的化学方程式为:。
【交流讨论】有同学认为,小敏的实验方案有欠缺,步骤②中存在安全隐患,理由是。
【反思提升】许多重大科学发现,源自对试验中异常现象的大胆质疑,深入研究。下列科学成果是通过对异常现象研究得出的是(填序号)。
A.侯德榜潜心研究制碱技术发明了联合制碱法
B.拉瓦锡深入研究前人忽视的异常现象发现了氧气
C.张青莲主持测定了多种元素相对原子质量的新值
(10分)人类的生产和生活都离不开金属。
(1)在图(1)所示条件下,铁钉锈蚀最快的是试管 (填序号),B装置说明铁生锈的条件是 。
(2)铝的大规模开发和利用比铜和铁晚,这是因为 。
(3)某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图(2)所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
通过观察,甲同学很快判断锌的活动性比铁强,据你分析,甲同学依据的实验现象是 ;
他发现铜片表面有银白色固体附着,这说明活动性Cu (填“>”“<”或“=”)Ag,反应的化学方程式是 。
(4)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
| 实验步骤 |
实验现象 |
实验结论 |
| |
|
|
(13分)某兴趣小组对鸡蛋壳的主要成分和含量进行了探究。
I.定性探究
实验一:探究鸡蛋壳的主要成分
【查阅资料】鸡蛋壳中含钙元素。
【实验步骤和现象】取一些鸡蛋壳予一支洁净的试管中,加入过量稀盐酸,产生无色无气味的气体,将该气体通入澄清石灰水中,石灰水变浑浊。
【结论】
写出该气体通入澄清石灰水中的化学反应方程式
实验二:做无壳鸡蛋
【实验步骤和现象】如图所示:将一个新鲜鸡蛋放入水中,鸡蛋沉入水底。加入量浓盐酸后,鸡蛋会出现上浮、下沉、再上浮、再下沉的现象,反复多次。最后变成无壳鸡蛋。
【解释与交流】用化学和物理知识解释鸡蛋上浮、下沉多次的原因
Ⅱ.定量探究
化学兴趣小组为了测定鸡蛋壳中主要成分的含量(其它成分不溶于水也不与酸反应)做如下实验。取用2.00 g鸡蛋壳样品,把20.00 g稀盐酸分4次加入样品中,充分反应后过滤,取滤渣,洗涤、干燥、称量,得实验数据如下:
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5.00 g |
1.50 g |
| 第二次加入5.00 g |
1.00 g |
| 第三次加入5.00 g |
0.50 g |
| 第四次加入5.00 g |
0.30 g |
(1)从以上数据可知,这四次实验中,第 次样品中主要成分已完全反应。
(2)(3)计算过程中和最后数字精确到0.01,若是百分数,则精确到0.1%]
(2)求鸡蛋壳中主要成分的含量和所用稀盐酸的溶质质量分数(写出计算过程)。
(3)在上述实验所得滤液中加30.00g水,加入 g氢氧化钙能使溶液pH等于7。此时,所得溶液的溶质质量分数为 。
(4)用36.5%的浓盐酸配制20.00g上述稀盐酸需加水的体积为 (保留一位小数)。
在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了下图所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。
(1)请将各实验的有关内容填入下表空格中:
| 实验序号 |
I |
II |
Ⅲ |
IV |
| 实验现象 |
小花变红色 |
小花不变色 |
小花不变色 |
小花______色 |
| 实验目的 和结论 |
目的:证明酸溶液能使石蕊变红色 |
目的:证明水不使石蕊变红色 |
目的:证明____ ______________ |
结论:CO2和水 反应生成酸 |
(2)写出二氧化碳和水反应的化学方程式:________________________;
(3)小芳若不做实验I,____(填“能”或“否”)得出CO2和水发生反应的结论;
(4)小芳在上述实验探究中,采用了实验___________的方法。
(5)写出二氧化碳使石灰水变浑浊的化学方程式 。
某品牌纯碱中含有少量氯化钠。某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:
【设计实验方案】实验装置(如图2所示,固定装置略去):
需要测定的实验数据:纯碱样品的质量;实验前后C装置(包含氢氧化钠固体)的质量。
(1)A装置中反应化学方程式是 。补充D装置 (简要叙述或画出装置示意图)。
【交流与表达】
(2)有同学认为图2所示实验装置会造成测得纯碱的纯度偏低,原因是 。
(3)为了克服图2装置的不足,有同学提出,还应增加图1装置与A装置连接(A装置中原双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入空气。
反应前,断开B、C装置之间的连接,用图1装置鼓入空气,反应后,用图1装置鼓入空气。在A装置中的反应进行时,开关K处于关闭状态,其原因是 。
【数据处理】
(4)称得纯碱样品的质量为10.8g,实验前、后C装置的总质量分别为75.2g和79.6g,纯碱的纯度
为 %(计算结果保留小数点后1位)。
【反思与评价】
(5)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是 。
(4分)某化学课堂围绕“酸碱中和反应”,在老师引导下开展探究活动,请你和同学们一起进行实验探究。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【知识梳理】该反应的化学方程式为(1) ;
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想与假设】
甲组:只有Na2SO4 乙组:有Na2SO4和H2SO4 丙组:有Na2SO4和NaOH
【收集证据】丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞试液溶液,无明显变化,溶液中一定没有(2) 。
【表达与交流】为了验证其余猜想,甲组同学的实验方案是取少量试液于试管中,滴加氯化钡溶液,观察是否有白色沉淀产生。你认为他们的实验方案(3) (填“正确”或“不正确”),你的理由是(4) 。
乙组同学取少量试液于试管中,加入(5)______ 溶液,振荡,观察到(6)___________________________,证明自己的猜想是正确的。
【反思与评价】为回收硫酸钠,应取剩余试液于烧杯中,加入(7)______ 溶液,充分搅拌,蒸发即可得到纯净的硫酸钠。
某校化学兴趣小组的同学探究如何利用水垢制取氯化钙。水垢的主要成分是CaCO3和Mg(OH)2,由水垢制取氯化钙的流程如下: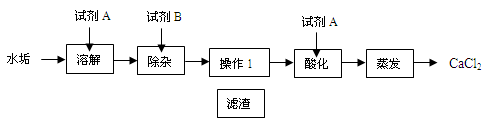
请回答:
(1)“试剂A”是一种酸,其化学式为 。
(2)“试剂B”是氢氧化钙,加入其除去的主要杂质离子是 ,所发生反应的化学方程式为 ;“试剂B”不能选用氢氧化钠,理由是 。
(3)“酸化”的主要目的是 。
(4)“操作1”中,需要用到的玻璃仪器除烧杯、玻璃棒外,还有 。
某兴趣小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行研究。
[查阅资料]
(1)过氧化钠化学性质很活泼,能与水、二氧化碳反应。
其中相关反应:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(2)Ba(NO3)2溶液、NaNO3溶液均为中性溶液
(3)[猜想与假设]猜想Ⅰ:固体为Na2O2、NaOH、Na2CO3
猜想Ⅱ:固体为NaOH、Na2CO3
猜想Ⅲ:固体为NaOH
猜想Ⅳ:固体为Na2CO3
[实验推断]
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量固体于试管中,加水振荡直至完全溶解。 |
________________ |
猜想Ⅰ不成立。 |
| ②取少量①的溶液于试管中,滴加过量的Ba(NO3)2溶液。 |
________________ |
证明有Na2CO3存在。该反应的化学方程式为________。 |
| ③取少量②的溶液于试管中,滴加无色酚酞试液。 |
________________ |
证明有NaOH存在。 |
| 综合以上实验现象,说明猜想Ⅱ是成立的。 |
[反思评价]过氧化钠在变质成碳酸钠过程中除了资料中显示的两个反应外,还可能发生了其他反应,请把该反应的化学方程式写在下列横线上:
________________________________________________________________。
[拓展迁移]小组同学认识到过氧化氢(Na2O2)应该____________保存。
下列除去物质中所含少量杂质的方法正确的是( )
| 选项 |
物 质 |
所含杂质 |
除杂质的方法 |
| A |
CO |
CO2 |
将混合气体通过灼热的氧化铜 |
| B |
NaCl |
泥沙 |
溶解、过滤、蒸发 |
| C |
NaOH |
Na2CO3 |
加适量Ca(OH)2溶液,过滤 |
| D |
Fe粉 |
Cu粉 |
加入足量稀硫酸,充分反应,过滤并干燥 |
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是 (填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)小燕完成该实验部分操作过程如图所示,其有明显错误 (填字母序号)。
(3)操作⑤中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取
等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
(5)小燕查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质;为了得到较纯净的氯化钠,小燕将除去泥沙的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种):
①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。
从提供的试剂中选出a所代表的试剂是 、 。
②在滤液中加盐酸的作用是 、 (用化学方程式表示)。
(6)井水中也因为含有较多的MgCl2、CaCl2而不能直接饮用,上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺。活性炭在此起 作用。
(7)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g
硫酸钠达到饱和。将该饱和溶液升高温度至90℃,
观察到的现象是 。
(7分) 已知某NH4NO3样品中可能混入了Cu、 CuO、 NH4Cl、 (NH4)2SO4四种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有发生的反应均恰好完全进行)。试根据实验过程和发生的现象填写以下空白: 
(1)气体 A的化学式是 。
(2)样品中一定含有的物质是(写化学式) 。
(3)滤液 B 中大量存在的金属离子为(写离子符号) 。
(4)写出过程④中发生的一个化学反应方程式 。
(5)样品中还不能确定存在的物质是 ,要进一步证明该物质是否存在,可用溶液D 再实验,请简要说明实验操作步骤、发生的现象及结论: 。
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
、 的性质。
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a: 、 b: 两个条件。
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1、在常温下Na2O2和CO2能发生化学反应。
2、无水硫酸铜为白色固体,吸水后变为蓝色。
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究。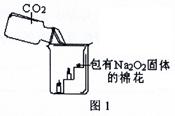
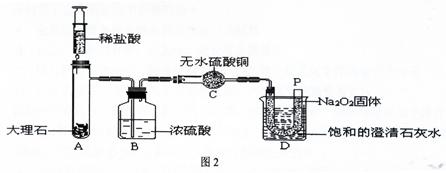
[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象。
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响。
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和的澄清石灰水变浑浊。
[实验分析]:①浓硫酸的作用是: 。
②D装置的烧杯内澄清石灰水变浑浊的原因是 。
[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将 能转化为热能,使图1中的棉花满足了燃烧的另一个条件。
[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为 同学的猜想是错误的,理由是: 。
②Na2O2和CO2反应的化学方程式是 。
某校化学小组同学从家中带来淀粉、食盐、纯碱、泡打粉、去污粉和部分变质的熟石灰6种固体物质。老师从中取出任意3种并编号,让小组同学通过实验确认分别为哪种固体。
【查阅资料】
1.该去污粉主要成分为碳酸钠和碳酸钙
2.该泡打粉的主要成分是碳酸氢钠和有机酸
3.熟石灰变质的原因是 (用化学方程式表示)。
【实验准备】
为顺利完成任务,小组同学在老师指导下进行了如下预备实验。部分现象记录如下:
| |
实验1 取样,加足量水充分溶解 |
实验2 取样,加入适量稀盐酸 |
| 淀粉 |
白色浑浊,试管底部有不溶物 |
无明显现象 |
| 泡打粉 |
有气体产生,试管底部有白色不溶物 |
有气体产生 |
【实验过程】
小组同学对老师提供的三种固体进行实验探究。部分现象记录如下:
| |
实验1 取样,加足量水充分溶解 |
实验2 取样,加入适量稀盐酸 |
实验3 取实验1上层清液,加入3滴酚酞溶液 |
| 固体Ⅰ |
有气体产生,试管底部有白色不溶物 |
有气体产生 |
|
| 固体Ⅱ |
固体溶解,形成无色溶液 |
有气体产生 |
溶液变红 |
| 固体Ⅲ |
有白色浑浊,试管底部有白色不溶物 |
有气体产生 |
溶液变红 |
【得出结论】
1.固体Ⅱ、Ⅲ加水形成的溶液pH 7 (填“>”、“<”或“=”);
2.分析以上实验现象得知,固体Ⅰ是 ,固体Ⅱ是 。
3.小组同学通过讨论认为固体Ⅲ不能确定。请你设计确认该固体的实验方案 。
【实验反思】
检验和鉴别也是实际生活中经常遇到的问题。面对多种物质的检验和鉴别,上述实验活动给我们的启示是 。
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如图1的实验装置。
图1
①实验装置乙中盛放的试剂为 ,
其作用是 ;
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你
认为他的理由是 ,应该将装置甲中双孔橡
胶塞换成三孔橡胶塞,并增加图2装置,实验结束后缓缓通入一段时间空气,
目的是 ,其中NaOH溶液的作用是 。
图2
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%,共3分)
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+ 4HCl → 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
【交流与讨论】
①甲同学认为测定产物中O2的体积即可测定样品的纯度。装置②的作用是:(15);装置③的作用是:(16);
②乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是;(17)(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
③丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,得到0.2mol氯化钠。则该样品的中过碳酸钠的质量分数为多少?(写出计算过程)