江苏省苏州市中考模拟化学试卷
从2012年3月7日开始,苏州正式实施环境空气质量新标准,向社会公布市区环境空气PM2.5实时监测数据,PM2.5指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。与较粗的大气颗粒物相比,PM2.5粒径小,很难被人体的呼吸系统过滤,富含大量的有毒、有害物质且大气中的停留时间长、输送距离远,因而对人体健康和人气环境质量的影响更大。下列哪些措施对PM2.5的治理能起到积极作用:
①加大产业结构调整,加快淘汰落后产能;②加强建筑工地、道路扬尘控制;③发展城市公共轨道交通和快速交通;④严厉查处焚烧垃圾、秸秆。
| A.①② | B.①②③ | C.①③④ | D.①②③④ |
物质的名称或俗称与化学式相对应正确的是
| A.天然气:CO | B.氨水:NH3 | C.熟石灰:Ca(OH)2 | D.苛性钠:KOH |
下列四组物质中,均属于氧化物的是
| A.干冰、氧化镁、二氧化锰 | B.水、二氧化硫、高锰酸钾 |
| C.空气、氧化铜、五氧化二磷 | D.氧气、氧化钙、四氧化三铁 |
分子、原子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是
| A.干冰 | B.黄金 | C.金刚石 | D.氯化钾 |
下列应用一定与中和反应原理无关是
| A.施用熟石灰改良酸性土壤 | B.服用含Al(OH)3的药物治疗胃酸过多 |
| C.实验室用浓硫酸做干燥剂 | D.用NaOH溶液洗涤石油产品中的残余硫酸 |
鉴定某溶液中是否含有CO32- ,应该选用的试剂是
| A.酚酞试液 | B.氢氧化钠溶液 |
| C.稀盐酸和澄清石灰水 | D.紫色石蕊试液 |
鉴别下列物质所使用的方法或试剂,错误的是
| A.氧气与氮气——闻气味 | B.氯化钠与碳酸钠——稀盐酸 |
| C.铝与铝合金——比较硬度 | D.氢氧化钠固体和碳酸钙固体——水 |
酸、碱、盐在工农业生产和日常生活中的广泛应用。下列有关酸、碱、盐的生产或应用的说法不合理的是
| A.高温煅烧石灰石可制得生石灰 |
| B.将氯化铵与草木灰(含K2CO3)混合施用 |
| C.用石灰乳与硫酸铜溶液混合配制防治植物病害的波尔多液 |
| D.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产 |
下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而减小的是
| A.氯化钾 | B.烧碱 | C.浓盐酸 | D.石灰水 |
为比较A、B、C 三种金属的活动性,某同学设计了图所示实验,由此判断三种金属活动性由强到弱的顺序是 
A.A>C>B B.A>B>C
C.C>A>B D.B>C>A
下列方程式符合题意且书写正确的是
A.医疗上用氢氧化镁中和过多胃酸:Mg(OH)2 +H2SO4 MgSO4+2H2O MgSO4+2H2O |
B.正常雨水的pH 约为5.6的原因:CO2+H2O H2CO3 H2CO3 |
C.证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl 2FeCl3+3H2↑ 2FeCl3+3H2↑ |
D.用稀盐酸除铁锈:HCl+Fe2O3 FeCl2+H2O FeCl2+H2O |
下列检测某溶液pH的操作正确的是
| A.将pH试纸投入待测液,对照标准比色卡读数 |
| B.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数 |
| C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数 |
| D.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数 |
下列氮肥中不属于铵态氮肥的是
| A.CO(NH2)2 | B.NH4HCO3 | C.NH4NO3 | D.(NH4)2SO4 |
下列各组物质,由金属跟同一种酸直接作用生成的是
| A.ZnSO4和FeSO4 | B.ZnCl2和ZnSO4 | C.FeCl2和FeCl3 | D.ZnSO4和Fe2(SO4)3 |
推理是化学学习中常用的思维方法。下列推理正确的是
| A.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 |
| B.酸和碱的溶液能与指示剂反应,所以所有的酸和碱都能使指示剂变色 |
| C.盐是由金属离子和酸根离子构成的,NH4NO3中没有金属离子,不属于盐 |
| D.盐酸溶液、硫酸溶液都能使石蕊试液变红,所以硝酸溶液也能使石蕊试液变红 |
进行化学实验必须注意安全,下列做法符合实际的是
| A.不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液 |
| B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜 |
| C.在实验室里可用品尝的办法区别食盐和蔗糖晶体 |
| D.直接把鼻孔凑到试剂瓶口闻浓盐酸气味 |
物质的性质决定其用途。下列物质的用途与性质对应关系错误的是
| A.氢氧化钙可用来改良酸性土壤——氢氧化钙溶液呈碱性 |
| B.氮气常用作保护气——氮气化学性质稳定 |
| C.固体二氧化碳可用人工降雨——二氧化碳能与碱反应 |
| D.氧化钙可做食品干燥剂——氧化钙能与水反应 |
下列有关物质所含元素质量比的数值正确的是
A.水(H2O) m(H):m(O)=1:8 B.乙炔(C2H2) m(C):m(H)=2:1
C.氨气(NH3) m(N):m(H)=14:1 D.二氧化硫(SO2) m(S):m(O)= 1:2
下列说法正确的是
| A.K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B.HCl、NaCl、NaOH三者饱和溶液的pH逐渐变大 |
| C.NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D.金、银、铜金属活动性顺序逐渐减弱 |
下列各组离子能在指定溶液中大量共存的一组是
| A.在稀硫酸中:Na+、Fe3+、OH- |
| B.在氢氧化钙溶液中:NH4+、Mg2+、NO3- |
| C.在氯化钾溶液中:Ag+、H+、CO32- |
| D.在硫酸铵溶液中:Na+、Cu2+、Cl- |
下列有关玻璃棒作用的描述错误的是
| A.过滤时:引流 | B.测溶液pH 时:蘸取 |
| C.捣碎固体时:研细 | D.加速固体溶解时:搅拌 |
下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是
| A.CO2气体(H2O)→固体氢氧化钠 | B.KNO3溶液(NaCl)→降温结晶 |
| C.C (CuO) →稀硫酸 | D.CO气体(CO2) →氢氧化钠溶液 |
下列物质间发生的化学反应属于复分解反应的是
| A.生石灰溶于水生产熟石灰 |
| B.氢氧化钠溶液与硫酸铜溶液混合产生蓝色沉淀 |
| C.锌粒与稀硫酸反应产生氢气 |
| D.碳酸不稳定,分解放出二氧化碳气体 |
下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中肯定错误的是 
| A.加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化 |
| B.等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化 |
| C.向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化 |
| D.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得烧杯中溶液导电性的变化 |
完成下列变化的化学方程式,并按要求填空。
(1)实验室加热高锰酸钾制取氧气: ;
在发生装置的试管口放一团棉花的作用是 。
(2)生石灰作干燥剂的反应:
;它是 (选填“吸热”或“放热”)反应。
(3)中和反应(试举一例):
;其基本反应类型是 。
(4)铝壶内的水垢(主要成分是碳酸钙)不能长时间用稀盐酸浸泡的原因是:
;其基本反应类型是 。
(5)少量硫酸铵固体中与氢氧化钠混合研磨:
;检验该气体可用 试纸。
已知碳酸氢钠加热能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解。现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,取4.0g 样品加热到质量不再减少时,共收集到二氧化碳气体0.88g。
(1)写出碳酸氢钠受热分解的化学方程式 。
(2)要得到干燥的二氧化碳气体,下图中盛放能吸水的浓硫酸,
生成的气体应从 (选填“a”或“b”)端导入。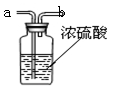
(3)求该样品中碳酸钠的质量分数。(写出计算过程)
中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行的。
②曲线上M点表示 。
③向烧杯中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为 色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 (结果精确到0.1%)。
(2)为证明中和反应是放热反应,某小组进行了如图所
示的实验操作:
根据上图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出
这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,
再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 |
A |
B |
C |
D |
E |
| 盐酸的溶质质量分数 |
5% |
10% |
15% |
20% |
25% |
| 反应后溶液温度(℃) |
24℃ |
34℃ |
46℃ |
54℃ |
54℃ |
实验结论:影响中和反应放出热量多少的因素 。
交流反思:反应后,烧杯内溶液pH最小的是 (填烧杯编号)。
已知甲醛的结构式为  ,则其化学式为 ,其相对分子质量
,则其化学式为 ,其相对分子质量
为 ,其含氧元素的质量分数等于 (结果精确到0.1%)。
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是 (填序号)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)小燕完成该实验部分操作过程如图所示,其有明显错误 (填字母序号)。
(3)操作⑤中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取
等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
(5)小燕查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质;为了得到较纯净的氯化钠,小燕将除去泥沙的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种):
①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。
从提供的试剂中选出a所代表的试剂是 、 。
②在滤液中加盐酸的作用是 、 (用化学方程式表示)。
(6)井水中也因为含有较多的MgCl2、CaCl2而不能直接饮用,上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺。活性炭在此起 作用。
(7)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g
硫酸钠达到饱和。将该饱和溶液升高温度至90℃,
观察到的现象是 。






 粤公网安备 44130202000953号
粤公网安备 44130202000953号