(7分)下图是自然界碳、氧循环简图
(1)图中③是自然界中消耗二氧化碳的主要途径,其名称为 。
(2)按序号和要求的反应类型完成下列化学方程式
反应①:化学方程式为 ,属于分解反应;
反应②:化学方程式为 ,属于化合反应;
反应④:化学方程式为 ,非基本反应类型。
根据反应事实可以推出影响化学反应的因素,下列推理中不合理的是
| 选项 |
化学反应事实 |
影响因素 |
| A |
木炭在纯氧中燃烧的火焰比在空气中燃烧的火焰更明亮 |
反应物浓度 |
| B |
粉末状大理石与盐酸反应比块状大理石更加剧烈 |
反应物种类 |
| C |
红磷在常温下与氧气不发生反应,加热后能与氧气反应 |
反应温度 |
| D |
双氧水在通常情况下难分解,加入二氧化锰后迅速分解 |
催化剂 |
(朝阳22)诺贝尔化学奖的成果之一是对CO催化氧化过程的研究,即一氧化碳在铂催化剂作用下的氧化反应,这一过程可以表示为:CO COad O2
COad O2 2Oad COad + Oad→CO2(式中标有ad的物质表示吸附在金属铂表面的原子或分子),下列说法错误的是
2Oad COad + Oad→CO2(式中标有ad的物质表示吸附在金属铂表面的原子或分子),下列说法错误的是
| A.CO和COad不是同种物质 |
| B.该反应过程中,一氧化碳发生了氧化反应 |
| C.从反应效果看,CO与O2不用点燃反应也能进行 |
| D.这一反应原理应用于汽车尾气处理,会使汽车一氧化碳的排放量减少 |
轻质碳酸钙的成分是CaCO3,是无味的白色粉末。它应用于铜版纸、邮票纸等纸制品中,可以提高纸制品的稳定性、硬度和耐热性。它在国内的工业生产方法主要是碳化法,生产流程如下:

(1)步骤③中包含的操作名称是 。
(2)上述步骤中,发生化合反应的化学方程式为 。
(3)石灰石与轻质碳酸钙的差别是 (写出一条)。
化学来源于生活,应用于生活。如果不合理使用化学品,可能会带来灾难。请看来自《柳州晚报》的两则报道。
案例一:2012年3月16日“南风天”,我市一夜87人发生煤气中毒。
案例二:有一居民不看产品使用说明书,就用含盐酸的“洁厕灵”与含次氯酸钠(NaClO)的碱性“84消毒液”混合使用,结果两者发生剧烈的化学反应,产生大量白色泡沫,同时有黄绿色的刺鼻的有毒氯气生成,导致中毒。
请回答:
(1)煤气的主要成分是什么?煤气使人中毒的原因是什么?
(2)通过两则案例,你想对家人或他人说些什么?
(3)请写出盐酸与次氯酸钠(NaClO)发生反应的化学方程式:
Ⅰ.某研究性学习小组的同学学习了二氧化碳的性质后,对二氧化碳溶于水的过程,有没有发生化学变化?提出实验改进:用如图所示装置进行实验,验证二氧化碳能与水反应(已知氮气的密度小于空气的密度),操作为:
①从a端通入二氧化碳
②从分液漏斗中滴加适量水
③将石蕊溶液染成紫色的干燥纸花放入广口瓶中
④从b端通入氮气;实验操作顺序最合理的是___,发生变化的化学方程式为 。
Ⅱ.另一小组在课外活动时对“二氧化硫能否与水反应生成酸”进行了实验探究。请你参与他们的探究活动,并回答有关问题。
[查阅资料]常温下二氧化硫是一种无色气体,易溶于水。
[假 设]二氧化硫能与水反应生成酸。
[设计实验](1)小雨同学将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色的变化。他认为,若紫色石蕊试液变 色,则证明假设成立。
(2)小涛同学认为小雨同学的实验方案不严密。小涛同学用紫色石蕊试液将白色滤纸染成紫色,干燥后做成三朵紫色的小花,然后按下列图示进行实验,在(I)、(Ⅱ)、(Ⅲ)中分别观察到变色和不变色的两种现象。
小涛同学认为,若 (填序号)中的紫色小花变色,则证明假设成立。
[交流反思]小明同学对小涛同学的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化硫和水反应生成了酸”,其理由是 。三位同学讨论后补充了一个实验,使探究活动获得了成功,你认为这个实验应该是 (简述实验步骤和现象)。
[结 论]通过上述实验得出:二氧化硫能与水反应生成酸。
对下图所示实验现象进行分析得出的结论中,错误的是
 |
 |
 |
 |
| A.甲烷燃烧生成二氧化碳和水 |
B.铁能在氧气中燃烧 |
C.白磷的着火点比红磷的低 |
D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
在学习"金属的冶炼"时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克。(所含杂质不参加反应)

(1)该实验利用了一氧化碳的性,玻璃管内观察到的现象是。
(2)甲同学的方法:先测出氢氧化钠浓溶液的质量为50克,待反应完全后再次称量,质量为54.4克。请你计算样品中氧化铜的质量分数。(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为
,待反应完全后再次称量,质量为
,利用
的值,求出样品中氧化铜的质量分数。其中
的值是指的质量。
(4)同学们查阅到
除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中还需对尾气进行处理。请你提出一种处理方法。
水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从图1装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写)。

(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要 。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是 。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为 L。
(3)科学家们又用“电解法”证明了水的组成(装置如图2所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是 。 通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是 (写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。
他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为 。
(5)用“氢气还原氧化铜”实验也可以证明水的组成(图3)。装置A中的玻璃管和其中物质在反应前后的质量差为m1,装置B和其中物质在反应前后的质量差为m2,据此可计算出水中O、H元素的质量比为 (用含 m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是 (写出一条即可)。
(6)碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是 。
同学们对实验“煅烧石灰石”展开了探究。资料:石灰石中的杂质高温不分解且不与稀盐酸反应

①为证明石灰石已分解,三位同学设计方案如下:
I.甲同学按图一所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 (1) 。
II.乙同学按图二所示进行实验,观察到B中液体变 (2) 色,A实验的作用 (3) 。
III.丙同学取一定质量的石灰石煅烧,一段时间后发现固体质量减轻,证明石灰石已分解。
你认为哪位同学的方案不合理?并写出理由 (4) 。
②为证明石灰石是否完全分解?丁同学对丙同学煅烧后的固体又进行了如下探究
| 实验步骤 |
实验现象 |
结 论 |
| (5) |
有气泡产生 |
石灰石未完全分解 |
某学习小组准备探究气体的测定和数据处理方法。
【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量。
【实验设计】通过下列两个实验分别测定CO2的质量和体积。

实验一 实验二
【分析处理】
实验一:
① 将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是 。
② 若稀盐酸足量,计算理论上能产生二氧化碳的物质的量 。(根据化学方程式进行计算)
实验二:
③ 先连接好装置,再 (填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是 。
④ 实验记录如下(表中数据在相同温度、相同压强条件下测定):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 注射器读数/mL |
60.0 |
85.0 |
88.0 |
89.0 |
89.5 |
89.8 |
89.9 |
90.0 |
90.0 |
90.0 |
根据以上实验过程和数据综合分析,最终生成CO2的体积是 mL。
【反思与评价】
⑤ 经过分析,下列说法错误的是 。
A.实验一的操作简单,便于读数
B.实验一最终得到的数据和通过计算得出的理论值完全相等
C.实验二在密闭体系内反应,更环保
D.实验二中若将碳酸钙粉末改成块状的大理石,更安全
草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解。小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如下图所示。请回答下列问题:

(1)t1~t2时问段内固体质量减少的原因是产生了一种极易与血红蛋白结合的有毒气体,该气体的化学式为 ;同时生成一种白色固体,它与大理石的主要成分相同,则该段时间内反应的化学方程式为 。
(2)t2~t3时间段内固体质量不变的原因是 。
(3)t3~t4时间段内反应的化学方程式为 。
(4)小强和小明另取12. 8g草酸钙固体加热一段时间后,对剩余固体的成分进行探究。
【查阅资料】CaC2O4能与稀盐酸反应,其反应的化学方程式为:CaC2O4+2HCl=CaCl2+H2C2O4;草酸(H2C2O4) 是一种可溶于水的酸;澄清的石灰水能使紫色石蕊变蓝。
【设计方案并实验】
| 同学 |
实验操作 |
实验现象 |
结论 |
| 小强 |
取少量固体放入烧杯中,加适量水并搅拌。静置后,取上层清液于试管中,滴加紫色石蕊溶液 |
溶液变蓝色 |
剩余固体中一定含有 。 一定不含有 。 可能含有 。 |
| 小明 |
另取少量固体放入试管中,加足量稀盐酸 |
有气体产生 |
剩余固体中一定含有 。 |
【交流与讨论】三位同学经交流后认为,该剩余固体与图中 时间段的物质成分相同。
如图所示,A瓶盛有澄清的石灰水,B瓶盛有紫色石蕊试液,C杯有高低不同的燃着的蜡烛。回答下列问题:
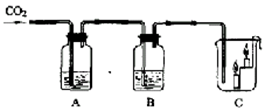
(1)A处澄清石灰水变浑浊了,写出这个过程发生的反应(用化学方程式表示)_____ ___
(2)B处紫色石蕊试液变红,这是因为( )
| A.二氧化碳使紫色石蕊变红 |
| B.水使紫色石蕊变红 |
| C.二氧化碳可使澄清石灰水变浑浊 |
| D.二氧化碳与水反应生成的碳酸使紫色石蕊变红 |
(3)C处出现的现象_____ ______;由此总结二氧化碳具有的性质:
①_____ _ _____;②_______ ____。
下列是初中化学部分重要的实验或实验装置。请按要求填空: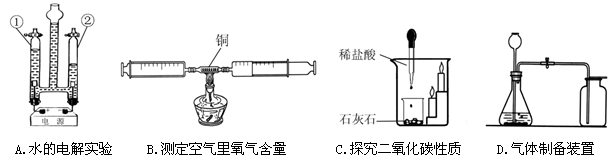
(1)A实验玻璃管②中产生的气体是 ;
(2)B实验如果实验数据小于21%,可能原因是 (写出一点);
(3)C实验说明二氧化碳具有的性质是 ;
(4)写出用D装置制取一种气体的化学方程式 。
某同学用如图所示装置进行实验,验证二氧化碳能与水反应(已知氮气的密度
小于空气的密度),操作为:
①从b端通入氮气 ②从分液漏斗中滴加适量水
③从a端通入二氧化碳④将石蕊溶液染成紫色的干燥纸花放入广口瓶中
⑤从a端通入氮气 ⑥从b端通入二氧化碳
其中实验操作顺序最合理的是
| A.④⑥⑤②⑥ | B.④③⑤②③ | C.④①③①② | D.④③①②③ |