下列除去混合物中少量杂质的方法或加入试剂合理的是
| 选项 |
物质 |
所含杂质 |
除去杂质的方法或加入试剂 |
| A |
CuSO4溶液 |
H2SO4 |
加入过量铜粉充分反应后过滤 |
| B |
CuO |
Cu |
在空气中灼烧 |
| C |
NaOH溶液 |
Na2CO3 |
加入稀盐酸至不再产生气泡 |
| D |
CaO |
CaCO3 |
加入足量蒸馏水,过滤 |
A、B、C、D、E是初中化学中常见的五种物质,它们都含有一种相同的元素,右图表示各物质之间的转化关系。其中,A为食盐的主要成分, B中含钡元素,D为有颜色溶液,E为蓝色溶液,其它物质的溶液都为无色;反应⑤和⑥为置换反应,其它均为复分解反应。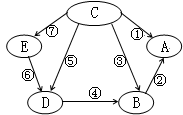
(1)写出物质C的化学式 。
(2)反应②的现象为 。
(3)反应⑥的化学方程式为 。
下列是四种实验操作中各量变化关系的图像,能正确反映其对应操作的图像有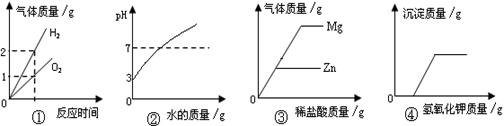
①电解水
②向一定量pH=3的盐酸溶液中不断加水稀释
③向等质量的镁和锌中分别加入溶质质量分数相同的稀盐酸至过量
④向盐酸和氯化铜的混合溶液中不断滴加氢氧化钾溶液
| A.4个 | B.3个 | C.2个 | D.1个 |
某工厂废料中含有铜、氧化铜和碳中的一种或几种,按如下流程进行反应,请回答:
① A、C、D、E四种物质中,属于氧化物的是 (13) (填字母)。
② 蓝色溶液B中含有溶质的化学式 (14) ,产生气体E的化学方程式 (15) 。
③ 由此可以确定废料的成分是 (16) 。
梧州市某中学化学兴趣小组的同学发现,熟鸡蛋在常温下放置一、两天后就会变臭了。富有营养而鲜美的鸡蛋,怎么会散发出臭味呢?同学们旋即对此进行了研究。
【提出问题】这种散发出刺激性臭味的无色气体是什么?它有怎样的性质?
【猜想假设】大家按照查阅到的鸡蛋中主要含有的元素是C、H、O、N、S的信息,及相应元素的化合价,列出了气体的可能存在形式分别有以下几组:
甲组—含碳化合物:CH4、CO、CO2
乙组—含氮化合物:NH3、NO、NO2
丙组—含硫化合物:SO2、SO3
虽然列出了上述可能,但大家都一致提议排除甲组的可能性,大家提出的理由是:__________________。
【查阅资料】
| 物质 |
NH3 |
NO |
NO2 |
SO2 |
SO3 |
| 一些特性 |
碱性 |
在空气中会迅速变成NO2 |
红棕色 |
酸性,有刺激性气味,能使KMnO4溶液褪色 |
沸点44.8℃ |
根据所查阅的资料,大家进一步排除了NO、NO2,理由是___________________;
也排除了SO3的可能,理由是_____________________________________________。
【实验验证】
毫无头绪的同学们向老师请教,老师笑而不语,拿出了两集气瓶的气体M,告诉大家这就是该刺激性臭味气体的主要成分,具有可燃性,至于还有什么性质,让大家在注意防护和试验安全的条件下进行探究。
(1)小吴同学用针筒抽取了部分气体M,注入盛有石蕊试液的试管中,结果没有看到溶液变_________的现象,证明该气体不是NH3;
(2)小周同学设法点燃了气体M,并拿一个干冷的小烧杯罩在火焰的上方,看到烧杯内壁有小水珠出现,说明了M气体中含有_______元素;燃烧后的气体带有刺激性,并能使另一个内壁沾有KMnO4溶液的小烧杯,出现红色褪去的现象,说明M气体中还含有_______元素。
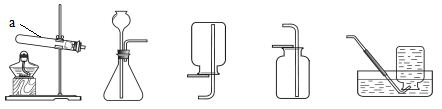
(3)为了进一步探究M气体的组成,小施将3.4g的M气体完全燃烧后,设法将燃烧后所得气体,全部通入如下装置进行中。(注:碱石灰为固体NaOH和CaO的混合物)
经充分吸收后称重,发现A装置增重1.8g,C装置增重6.4g。通过计算可知,除了上述小周确定的两种元素外,M气体中________(填“含”或“不含”)其他元素;并确定了M的化学式为___________。而上图中B装置的作用是___________________;D装置的作用是__________________。经过严谨的思考与细致的实验,同学们终于揭开了这种气体的组成。
下列有关物质鉴别方案正确的一组是
| A.MgCl2溶液、NaOH溶液、H2SO4溶液、CuSO4溶液,不加任何试剂即可鉴别 |
| B.可用Ba(OH)2溶液鉴别(NH4)2CO3、(NH4)2SO4、NH4NO3三种氮肥 |
| C.Na2CO3溶液、Ca(OH)2溶液、盐酸、BaCl2溶液,不加任何试剂即可鉴别 |
| D.CuO粉末、炭粉、铁粉,三种黑色粉末用一种试剂就可鉴别 |
有A~F六种无色的液体,其中E溶液有咸味,其溶质可作为调味品,其余分别是稀盐酸、碳酸钠溶液、氢氧化钠溶液、氢氧化钙溶液、水中的某一种,请根据下面实验现象回答问题。
(1)将少量A分别滴入适量的B、C、D、F中,均没有明显现象。
(2)将少量B分别滴入适量的A、C、D、F中,C中有气泡出现,其余均没有明显现象。
(3)将少量D分别滴入适量的A、B、C、F中,均没有明显现象。
①溶液E中的溶质是 。
②写出B滴入C中发生反应的化学方程式 。
③根据实验现象能判断出的:B是 C是 F是
④对还没有确定的溶液(或液体),下列几种鉴别方法中,正确的是 (填序号)。
A.分别滴加硫酸铜溶液 B.分别滴加澄清石灰水
C.分别滴加石蕊溶液 D.分别滴加稀盐酸
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程图如下:
【查阅资料】①一般情况下,难溶性碱受热易分解,生成对应的金属氧化物和水;
②Mg(OH)2和Zn(OH)2开始沉淀和沉淀完全时的pH如下表所示:
| |
Mg(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
10.4 |
6.4 |
| 沉淀完全的pH |
12.4 |
8.0 |
| 开始溶解的pH |
—— |
10.5 |
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是 ;
(2)针铁矿的组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数= ;(提示:氢原子数目小于氧原子数目)
(3)“滤液4”之前加入锌粉的目的是 ;
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是 (选填序号);
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)完成这个流程中发生的化学反应方程式:
4Fe(OH)2+Ca(ClO)2+2 =4Fe(OH)3+CaCl2,
(5分)下图中的A~G是初中化学常见的纯净物,且均含有一种相同的元素。其中A的饱和溶液加热后会变浑浊,B、C是氧化物;E是发酵粉的主要成分,E、G分别与足量F反应的生成物相同。图中“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去。
(1)写出C的化学式
(2)在B和C的混合物中滴加无色酚酞溶液,酚酞溶液显
(3)写出F和D反应的化学方程式
(4)写出G的一种用途
一包白色粉末可能有CaCO3、K2SO4、CuSO4、BaCl2、K2CO3的一种或几种,现在进行如下实验。其中说法错误的是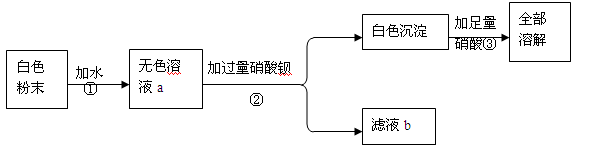
| A.由操作①可知:白色粉末中一定没有CaCO3、CuSO4 |
| B.由操作②可知:白色粉末中一定没有BaCl2 |
| C.由操作③可知:白色粉末中一定有K2CO3可能有K2SO4 |
| D.滤液b中的溶质有2种 |
已知甲、乙、丙、丁是初中化学常见的物质,它们之间转化关系如图: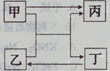
若甲、丁是常见的碱,乙、丙是常见的盐,而且当甲转化为丙、丁转化为乙时,都是与同一种气体X发生反应。则X的化学式为 ,甲与乙反应的化学方程式为 :丁转化为乙的化学方程式为 。
氢化镁(MgH2)常被作为储氢介质,它与几种物质的转化关系如下。已知B、E之间发生中和反应,且F是一种盐酸盐。(所有的反应物和生成物均已标出)
(1)写出E的化学式:____。
(2)在实验室发生A→C+D的反应条件是____。
(3)C作为一种新能源具有很多优点,试写出其中的一个优点:____。
(4)写出MgH2+A→B+C的化学方程式:____。
现欲探究一固体粉末状混合物A的成分,已知其中可能含有CuSO4、BaCO3、NH4NO3、Fe2O3、NaCl五种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。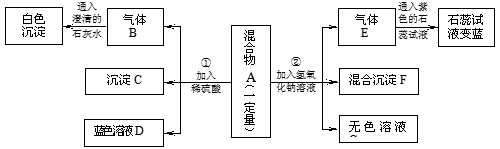
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)①沉淀C的化学式为 , ②气体E的化学式为
(2)在混合物A中,肯定不存在的物质是 (写化学式)
(3)在混合物A中,肯定存在的物质是 (写化学式)
(4)溶液D中一定存在的金属阳离子为 (写离子符号)
(5)写出实验过程②中肯定发生的一个反应化学方程式:
一包混有杂质的Na2CO3,其杂质可能是Ca(NO3)2、KCl、NaHCO3,今取10.6g样品,溶于水得澄清溶液,加入足量的盐酸,收集到4gCO2,则下列判断正确的是
| A.样品中只含有NaHCO3 |
| B.样品中一定混有NaHCO3,可能有KCl |
| C.样品中有NaHCO3,也有Ca(NO3)2 |
| D.样品中混有KCl,也可能有NaHCO3 |
某化学兴趣小组设计了一组有关气球变化的实验,三套装置如下图: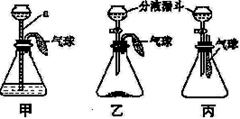
(1)甲装置:若该装置的气密性良好,则向a中加水会看到 。
(2)乙装置:若锥形瓶中装有生石灰,由分液漏斗加入少量水,则气球胀大的主要原因是_________。
(3)丙装置:若锥形瓶中盛满CO2,通过发生化学变化使气球胀大,且生成物之一属于盐类,则分液漏斗中的液体可以是________。该反应的化学方程式为 。