某同学为了测定铜镁合金样品中铜的质量分数,将100
稀盐酸分2次加入到盛有5
该样品的烧杯中,所得数据如下表,则下列说法中错误的是
| 次数 |
实验前 |
第1次 |
第2次 |
| 加入稀盐酸的质量/ | 0 |
50 |
50 |
| 剩余固体的质量/ | 5 |
3 |
2 |
| A. |
第1次加入稀盐酸后剩余固体中还有镁 |
B. |
第2次所加入的稀盐酸未反应完 |
C. |
每50 稀盐酸和1 镁恰好完全反应 |
D. |
合金样品中铜的质量分数为40% |
黄铜(铜锌合金)是重要的金属材料,常用来制造机械零件,仪表和日用品。为测定黄铜材料中锌的含量,化学研究小组进行了实验:称取
此黄铜材料,向其中逐渐加入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸的关系图。请你仔细分析此关系图,并进行计算:

(1)
黄铜材料中含锌
。
(2)稀盐酸中溶质的质量分数(写出计算过程,计算结果精确到0.1%)
二氧化硫是一种无色具有刺激性气味的气体,它进入大气后可形成硫酸型酸雨。
(1)煤、石油、木柴中都含有硫元素,点燃后均会产生二氧化硫气体,可用 溶液检验该气体的存在。
(2)为减少大气污染,火力发电厂采用以下两种方法吸收废气中的二氧化硫。
①用氨水吸收废气中的二氧化硫,其反应原理可用化学方程式表示为 。已知:亚硫酸盐不稳定,易被空气中的氧气氧化成硫酸盐。
②用石灰石浆吸收废气中的二氧化硫,其反应原理是:
2CaCO3+O2+2SO2 2CaSO4+2CO2
2CaSO4+2CO2
若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?
向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过滤,得到溶质质量分数为14.2%的无色溶液10g。请计算:
(1)所得溶液中溶质的质量是;
(2)实验前试管中氢氧化钠溶液的质量。
某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
| 反应前物质的质量/g |
充分反应后物质的质量/g |
|
| 过氧化氢溶液 |
二氧化锰 |
固体与液体混合物质量 |
| 68.0 |
0.1 |
66.5 |
请计算:
(1)该同学制得氧气的质量为。
(2)该同学所用过氧化氢溶液的溶质质量分数。(相对原子质量:
-1
-16)
某石灰水中含有氢氧化钙 ,如果该石灰水吸收二氧化碳完全反应变成白色沉淀,则可以吸收二氧化碳的质量是多少()?
实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中固体的质量变化如下:

①生成氧气的质量
,其物质的量为
。
②求参加反应的氯酸钾的物质的量。(根据化学方程式列式计算)
非物质文化遗产"芜湖铁画"(镀金)含有金.铁(其他成分忽略不计)。某同学取一定质量的铁画边角料,加入足量稀盐酸,充分反应后,放出0.3g
,剩余固体质量为0.1g。
(1)求样品中铁的质量。
(2)求样品中金的质量分数。
某实验小组为了测定某石灰石样品中碳酸钙的质量分数,取 25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请计算:
(1)样品中碳酸钙的质量分数是多少?
(2)所用稀盐酸溶质的质量分数是多少?
为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与-定质量的7.3%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2g(不含结晶水,假设样品中的杂质既不与稀盐酸反应也不溶于水)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
(3)上述反应所得滤液中溶质的质量分数。
为测定某铜锌合金中的铜质量分数,某校化学兴趣小组用该合金与稀硫酸反应,进行了三
次实验。
| |
第一次 |
第二次 |
第三次 |
| 所取合金质量/g |
12.5 |
12.5 |
25 |
| 所用稀硫酸质量/g |
120 |
140 |
100 |
| 生成氢气的质量/g |
0.2 |
0.2 |
0.2 |
所有的相关数据记录见下表(实验误差忽略不计);
(1)计算该合金中铜的质量分数;
(2)求第三次实验所得溶液中溶质的质量分数。
人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
| A.青铜 | B.铝 | C.钢 | D.生铁 |
(2)每年因腐蚀而报废掉的金属材料数量惊人,铁生锈的条件是铁与 和 同时接触。
(3)工业炼铁可以把赤铁矿(主要成分为Fe2O3)在高炉里和CO反应,生成单质铁,
该反应的化学方程式是 ;
①氧化铁(Fe2O3)的相对分子质量是 ;
②2000t含氧化铁80%的赤铁矿中理论上可炼得含铁90%的生铁 t(保留一位小数)。
(8分)现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:(注意:100g是Fe与Fe2O3两种物质的总质量)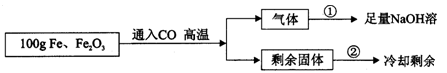
【实验数据】实验共记录了两组实验数据:
第①组,完全吸收气体后,NaOH溶液质量增加了66g;
第②组,完全反应,冷却后称量剩余固体的质量为Wg。
根据实验设计及有关数据进行分析与计算。
(1)根据第①组数据,CO与Fe2O3,反应产生CO2 g。
(2)混合物中Fe2O3的质量为多少?
(3)第②组数据W是 g。
(4分)为定量研究长期放置氢氧化钠药品变质情况,化学兴趣小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将55.0g试样放入锥形瓶中,加入足量稀硫酸溶液;
Ⅱ.测量一定时间内装置丁内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量装置丁内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至装置丁内物质质量不变.
请根据实验数据,通过计算分析氢氧化钠变质情况(“全变质”,“部分变质”或“不变质”,要有详细的计算步骤,没有步骤不得分)
在烧杯中加入7.31g的表面氧化的锌片,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
(1)产生氢气的质量是 g。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)锌片恰好完全反应时,溶液中溶质的质量。