实验室中分别用高锰酸钾、过氧化氢、氯酸钾制取比较纯净的氧气。请你按照要求回答问题:
(1)结合下图所提供装置完成下列表格
填写内容/反应物 |
化学方程式 |
气体制取装置组合(填序号) |
高锰酸钾 |
例:2KMnO4 |
|
过氧化氢(二氧化锰) |
|
|
氯酸钾(二氧化锰) |
|
/ |

(2)请结合图回答问题:
①写出甲、乙所指仪器名称:甲 ;乙 ;
②用过氧化氢制氧气的装置与其他两种方法的装置相比具有的优点: , (写出两条);
③若用如图装置收集一瓶氧气,气体应从 (填a或b)端进入集气瓶。

根据如图装置图,回答问题。
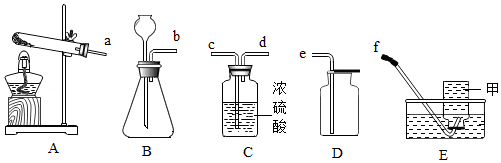
(1)图中仪器甲的名称是 ;
(2)请写出实验室制取二氧化碳的化学方程式 ;
(3)实验室若要制备一瓶干燥的氧气,下列装置的连接顺序正确的是 (填数字序号)。
①b→e
②a→e
③b→d→c→e
④b→c→d→e
根据如图,回答下列问题。

(1)图中标有序号①的仪器名称是 。
(2)实验空中高锰酸钾制取氧气,反应的化学方程式是 ,应选择的发生装置是 (填序号)。
(3)若用D装置收集氢气,则气体应从 填(“a”或“b”)端进入。
盐酸是重要化工产品。
(1)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式 。
(2)盐酸具有挥发性,在空气中打开盛有浓盐酸的试剂瓶瓶盖,在瓶口处观察到的现象是 。
(3)氨水也具有挥发性,可挥发出氨气。如图,在 a、b 处放有浸泡过浓盐酸或浓氨水的棉花,过一会在 c 处可观察到的现象是 ,a 处是放有浸泡过 的棉花。(已知:①NH3 与 HCl 在空气中相遇可反应生成白色固体 NH4Cl;②相对分子质量越小的气体扩散速度越快)
(4)实验室可用NH4Cl 与Ca(OH)2 固体加热发生复分解反应制取 NH3,请写出此反应的化学方程式 ,收集 NH3可用向 排 空气法。

氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:
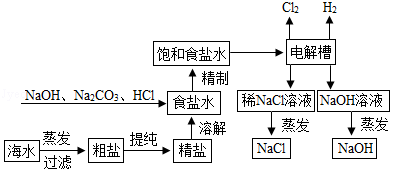
(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 |
氢氧化钠含量 |
碳酸钠含量 |
优等品 |
≥99.0% |
≤0.5% |
一等品 |
≥98.5% |
≤0.8% |
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
氧气在中学化学中有着举足轻重的地位。
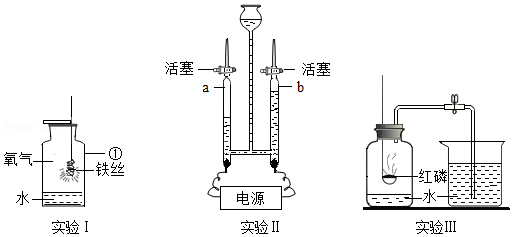
(1)实验Ⅰ中仪器①的名称为 ,现象为铁丝剧烈燃烧,火星四射,产生 色固体。
(2)实验Ⅱ为电解水制氧气,发生反应的化学方程式为 。气体a在电源的 (填“正”或“负”)极端产生。
(3)实验Ⅲ为测定空气中氧气含量的实验,在瓶内加入少量水、并将水面上方空间分为5等份,接下来的实验步骤依次为 (填序号),最后打开弹簧夹。
①冷却到室温
②弹簧夹夹紧橡皮管
③点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧
能源、环境与人类的生活和社会发展密切相关。
(1)煤的使用在方便人们生活的同时,也对环境造成了不良影响,含硫煤不完全燃烧产生的气体污染物有 。因此应大力提倡使用新能源,下列不属于新能源的是 (填字母序号)。
A.太阳能 B.风能 C.石油
(2)乙醇汽油作为燃料的优点是 (答一点即可)。
(3)二甲醚( CH3OCH3)被认为是21世纪新型燃料,二甲醚在空气中充分燃烧生成二氧化碳和水,该反应的化学方程式是 。
根据下列装置,结合所学化学知识,回答下列问题:

(1)E图中仪器①的名称是 ;
(2)实验室制取并收集较纯净的氧气,小华同学已选用A装置作为发生装置,则他还需要选择的装置或仪器有 (填装置序号),该反应的化学方程式是 。小华利用上述收集方法收集到的氧气不纯,导致其不纯的原因可能是 (任写出一点);
(3)实验室利用硫化亚铁固体和稀硫酸混合制取硫化氢气体,通常选择的发生装置是 (填装置序号)。这个反应属于复分解反应,对应的化学方程式是 。
自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
实验操作 |
实验现象 |
实验结论 |
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
在实验室里可采用多种方法制取氧气。
(1)写出用如图装置制氧气的化学方程式 。(写出一个即可)
(2)收集氧气可以采用排水法,这是利用了氧气的什么性质? 。

实验室利用如图所示装置进行相关实验。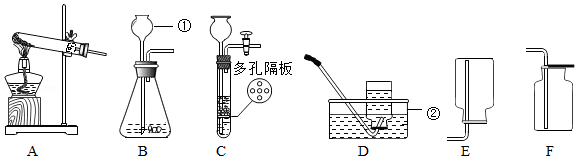
回答下列问题:
(1)写出装置图中标号仪器的名称:① ,② 。
(2)用高锰酸钾制氧气,应选用的发生装置是 (填字母序号),该反应的化学方程式为 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 。
(3)常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的发生装置是 (填字母序号),反应的化学方程式为 ;点燃氢气前必须验纯,为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。
根据下列图示,回答相关问题
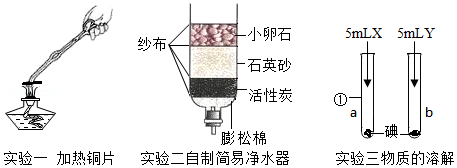
(1)实验一:实验中铜片上出现的现象是 ,该反应的化学方程式是 。
(2)实验二:自制简易净水器中小卵石,石英砂和蓬松棉的作用是 。
(3)实验三:仪器①的名称是 ;X、Y分别是水和汽油中的一种,加入X、Y后,观察到a中固体消失并得到棕色溶液,b中固体不消失,则物质X是 ,由实验可知,物质的溶解性与 有关。
在实验过程中常会得到混合物,请完成下列问题。
(1)当用稀盐酸和大理石制取二氧化碳时,二氧化碳气体中常混入氯化氢,原因是 。可以用饱和碳酸氢钠溶液吸收氯化氢气体,该反应的化学方程式为 。
(2)过量的铁粉与硫酸铜溶液充分反应后过滤,得到滤渣的成分是 ,向滤渣中加入足量稀硫酸可回收金属铜。上述反应所涉及的化学反应基本类型是 。
酸碱盐在工农业生产和生活中应用广泛,请用所学化学知识回答问题。
(1)日常生活中有以下常见物质:白醋、纯碱、苛性钠、小苏打、硫酸铵,其中属于碱的是 (填上述物质)。将少量无色酚酞溶液滴加到碱溶液中,溶液变 。
(2)如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式 。
A.NaOH B.Na2CO3 C.Al(OH)3
(3)某氯化钠样品中,可能含有杂质:BaCl2、MgCl2、Na2SO4中的一种或几种,某校课外化学兴趣小组的同学进行实验探究杂质成分,探究过程如图(已知氢氧化镁难溶于水):

根据以上实验信息,用 操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 ,写出杂质与Na2SO4溶液反应的化学方程式 。