下列有关概念应用的判断正确的是
| A. | 、 、 、 等都含氧元素,都属于氧化物 |
| B. | 可燃物与氧气发生的氧化反应都属于燃烧反应 |
| C. | 生铁和钢都与铁的性质有所不同,都属含碳量不同的铁合金 |
| D. | 凡是生成盐和水的化学反应都是中和反应 |
一些食物的近似pH如下:
| 食物 |
葡萄汁 |
苹果汁 |
牛奶 |
鸡蛋清 |
| pH |
3.5~4.5 |
2.9~3.3 |
6.3~6.6 |
7.6~8.00 |
下列说法中不正确的是
A.苹果汁比葡萄汁的酸性强 B.苹果汁和葡萄汁显酸性
C.鸡蛋清和牛奶显碱性 D.胃酸过多的人应少饮苹果汁和葡萄汁
下列图象分别表示对应的四种操作过程,其中表示正确的图像是
| A.①加热氯酸钾和二氧化锰固体至质量不再减轻,固体中二氧化锰的质量 |
| B.②向pH=1的硫酸溶液中逐滴加入pH=13的氢氧化钠溶液 |
| C.③某温度下,向一定量的水中持续加入食盐并不断搅拌,所得溶液的质量分数 |
| D.④等质量的锌、铁与足量的同种稀硫酸反应,产生氢气的质量M与反应时间 |
小明同学在实验室中测定某酸性溶液的pH,他的实验操作如下:先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,你认为小明同学这样测得的结果与该溶液的实际pH比较
| A.偏低 | B.偏高 | C.不变 | D.无法判定 |
某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是()
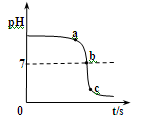
| A. | 图中c点所示溶液呈碱性 |
| B. | 图中a点所示溶液中,含有的溶质是 和 |
| C. | 该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 |
| D. | 由a点到b点的pH变化过程证明酸和碱发生了中和反应 |
推理是化学学习的一种方法,以下推理正确的是
| A. | 单质中只含有一种元素,因此只含有一种元素的物质一定是单质 |
| B. | 碱性溶液能使酚酞试液变红色,因此能使酚酞试液变红色的溶液的 一定大于7 |
| C. | 在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定显负价 |
| D. |
稀有气体元素的原子最外层电子数为8(氦除外),因此微粒
 一定是稀有气体元素的原子 一定是稀有气体元素的原子
|
下面图示为某些物品对应的pH范围,其中显弱碱性的是()

| A. | 小苏打 | B. | 杨梅 | C. | 栗子 | D. | 菠萝 |
化学与生活密切相关,下列叙述中正确的是
| A. | 胃酸过多的人应少饮葡萄汁(葡萄汁的 为3.5---4.5) |
| B. | 为了个人卫生,应全部使用一次性的木筷和餐盒 |
| C. | 人体缺锌会引起生长发育缓慢,因此锌元素摄入得越多越好 |
| D. | 铵态氮肥与草木灰混合使用可以明显提高肥效 |
下列物质之间不能发生化学反应的是
| A. | 石灰水与稀盐酸 | B. | 铜与硝酸银溶液 |
| C. | 银与稀硫酸 | D. | 二氧化碳与水 |
测定人体内或排出的液体
,可以帮助人们了解身体的健康状况,人体内的一些体液近似
如下:
| 液体 |
胃液 |
胰液 |
胆汁 |
血浆 |
| 0.9-1.5 |
7.5-8.0 |
7.1-7.3 |
7.35-7.45 |
下列液体中,碱性最强的是
| A. |
胃液 |
B. |
胰液 |
C. |
胆汁 |
D. |
血浆 |
2015年苏州市初中化学实验操作考查内容为"溶液酸碱性的检验"。请根据实验回答下列问题。
(1)测得碳酸饮料的pH7(填"〈"或"="或"〉")。
(2)下列使用pH试纸的方法中,正确的是(填序号)。
| A. | 将pH试纸剪成几段使用 |
| B. | 将pH试纸直接插入待测液中 |
| C. | 将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上 |
| D. | 将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上 |
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
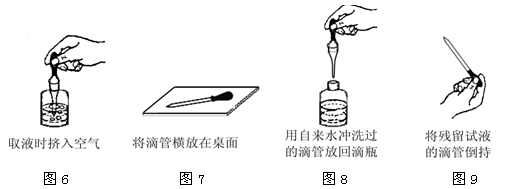
(3)本次实验中滴管使用出现了如图6~图9所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法。
(4)使用白色点滴板完成实验有显色明显、便于对比、(填一项)等优点。
形成化学观念是化学学习的任务之.下列说法中,错误的是
| A.pH=0的溶液一定是中性溶液 |
| B.元素周期表中原子序数等于该元素原子核内的质子数 |
| C.化学变化的过程中常会伴随能量变化 |
| D.复分解反应前后各元素的化合价均未发生变化 |
(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行。
②曲线上M点表示 。
③向烧杯中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 (结果精确到0.1%)。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
根据上图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
实验结论:影响中和反应放出热量多少的因素 。
交流反思:反应后,烧杯内溶液pH最小的是 (填烧杯编号)。
某学校化学课外兴趣小组,取刚降落到地面的雨水水样,用pH计(测pH的仪器)每隔10分钟测一次pH,数据如下表所示,下列说法错误的是
| A.根据表中数据可以判断该降雨属于酸雨 |
| B.上述表中的pH数据也可以通过广泛pH试纸进行测定得到 |
| C.雨水放置的30分钟内,酸性在不断增强 |
| D.雨水酸性发生变化的原因可能是雨中的某种物质和空气中的氧气发生了反应 |